题目内容
20. 如图为相互串联的甲、乙两电解池试回答:
如图为相互串联的甲、乙两电解池试回答:(1)若甲池利用电解原理在铁上镀银,则A是Fe,;,AgNO3溶液(填电极材料),
电极反应式是Ag++e-═Ag;B是Ag(填电极材料),电极反应式是Ag-e-=Ag+,应选用的电解质溶液是AgNO3溶液.
(2)乙池滴入少量酚酞试液,电解一段时间,Fe(填“C”或“Fe”)极附近呈红色.
(3)若甲槽阴极增重43.2g,则乙槽中阳极上放出的气体在标况下的体积是4.48L.
分析 根据电源的正负极可判断A、B、Fe、C分别为电解池的阴极、阳极、阴极、阳极,在阴极上发生还原反应,在阳极上发生氧化反应,乙池反应中阴极:2H2O+2e-═H2↑+20H-,阳极:2Cl--2e-═Cl2↑,若甲为用电解原理给铁片镀银的装置,阴极反应为Ag++e-=Ag,阳极反应为Ag-e-=Ag+,电解质溶液应选与镀层具有相同金属离子的可溶性盐溶液;然后根据电极反应以及两个串联电解池转移电子数目相等计算.
解答 解:(1)根据电源的正负极可判断A、B、Fe、C分别为电解池的阴极、阳极、阴极、阳极,在阴极上发生还原反应,在阳极上发生氧化反应,在铁片上镀银时,镀层金属银为电解池的阳极,阳极上的电极反应式为Ag-e-=Ag+,镀件金属铁为电解池的阴极,阴极上的电极反应式Ag++e-=Ag,电解质溶液含有镀层金属离子,应为可溶性硝酸银溶液.
故答案为:铁;Ag++e-=Ag;Ag;Ag-e-=Ag+;AgNO3溶液;
(2)乙池电解NaCl溶液,阴极铁电极反应为:2H2O+2e-═H2↑+20H-,滴加酚酞溶液后,阴极溶液变红.故答案为:Fe;
(3)甲槽阴极反应为Ag++e-=Ag,阴极增重43.2g,应为银的质量,n=$\frac{43.2g}{108g/mol}$=0.4 mol,转移的电子为0.4mol,两个电解池串联,转移的电子数目相等,乙槽阳极反应为2Cl--2e-═Cl2↑,转移的电子为0.4mol时,在阳极上生成气体的物质的量为0.2mol,
放出气体在标准状况下的体积为0.2mol×22.4L/mol=4.48L.
故答案为:4.48.
点评 本题考查了电镀原理及氧化还原反应的有关计算,难度不大,注意串联电解池得失电子数相等的特点.

练习册系列答案
相关题目
10.化学在生产和生活中有重要的应用.下列说法正确的是( )
| A. | 电解饱和食盐水可冶炼金属钠 | |
| B. | 氧化钠可用于呼吸面具 | |
| C. | 铝热反应中的铝热剂是混合物 | |
| D. | 凡含有添加剂的食物对人体健康均有害,不宜食用 |
11.下列说法中正确的是( )
| A. | 摩尔既是物质的数量单位又是物质的质量单位 | |
| B. | 常温常压下,48gO2所占的体积是33.6L | |
| C. | 阿伏加德罗常数的数值就是0.012kg12C中含有的碳原子数目 | |
| D. | 把1molNaCl溶于1L水中,所得溶液物质的量浓度为1mol/L |
8.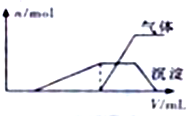 一份溶液中可能含有K+、Al3+、H+、NH4+、Cl-、Br-、I-、ClO-、AlO2- 等离子中的若干种.为了确定溶液的组成,进行了如下操作:
一份溶液中可能含有K+、Al3+、H+、NH4+、Cl-、Br-、I-、ClO-、AlO2- 等离子中的若干种.为了确定溶液的组成,进行了如下操作:
(1)往该溶液中逐滴加入NaOH溶液并适当加热,产生沉淀和气体的物质的量(n)与加
入NaOH溶液的体积关系如图所示;
则该溶液中一定存在的离子是Al3+、H+、NH4+,一定不存在的离子是ClO-、AlO2-.
(2)经检测后,该溶液中含有大量的Cl-、Br-、I-,若向1L该混合溶液中通入一定量的氯气,则溶液中Cl-、Br-、I-与通入氯气的体积(标况下)关系如图所示,回答下列问题:
①则a为0.15
②原溶液中Cl-、Br-、I-的物质的量浓度之比为10:15:4.
 一份溶液中可能含有K+、Al3+、H+、NH4+、Cl-、Br-、I-、ClO-、AlO2- 等离子中的若干种.为了确定溶液的组成,进行了如下操作:
一份溶液中可能含有K+、Al3+、H+、NH4+、Cl-、Br-、I-、ClO-、AlO2- 等离子中的若干种.为了确定溶液的组成,进行了如下操作:(1)往该溶液中逐滴加入NaOH溶液并适当加热,产生沉淀和气体的物质的量(n)与加
入NaOH溶液的体积关系如图所示;
则该溶液中一定存在的离子是Al3+、H+、NH4+,一定不存在的离子是ClO-、AlO2-.
(2)经检测后,该溶液中含有大量的Cl-、Br-、I-,若向1L该混合溶液中通入一定量的氯气,则溶液中Cl-、Br-、I-与通入氯气的体积(标况下)关系如图所示,回答下列问题:
| Cl2的体积(标况下) | 2.8L | 5.6L | 11.2L |
| n(Cl- ) | 1.25mol | 1.5mol | 2mol |
| n(Br- ) | 1.5mol | 1.4mol | 0.9mol |
| n(I- ) | a mol | 0 | 0 |
②原溶液中Cl-、Br-、I-的物质的量浓度之比为10:15:4.
15.将一定量的金属钠放入一定浓度的氢氧化钠溶液中,反应完全后,恢复到原温度,氢氧化钠的浓度( )
| A. | 增大 | B. | 减小 | C. | 不变 | D. | 不能确定 |
5.下列反应的离子方程式书写正确的是( )
| A. | 98.3%的硫酸加入到稀氢氧化钡溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol | |
| B. | 向NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应是:3NH4++Fe3++3SO42-+3Ba2++6OH-═3BaSO4↓+Fe(OH)3↓+3NH3•H2O | |
| C. | 酸化的淀粉碘化钾溶液在空气中变蓝:4I-+O2+4H+═2I2+2H2O | |
| D. | Na2SO3溶液使酸性KMnO4溶液褪色:5SO32-+6H++2MnO4-═5SO42-+2Mn2++3H2O |
4. 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:
CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓))}$CH2═CH2
CH2═CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.用少量的溴和足量的乙醇制各1,2-二溴乙烷的装置如图所示:
有关数据列表如下:
回答下列问题:
(1)在此装置各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发d.减少副产物乙醚生成
(2)在装置C中应加入c,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该装置各反应已经结束的最简单方法是溴的颜色完全褪去;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);
(5)若产物中有少量副产物乙醚,可用蒸馏的方法除去;
(6)反应过程中应用冷水冷却装置D,其主要目的是避免溴大量挥发;但又不能过度冷却(如用冰水),其原因是产品1,2-二溴乙烷的沸点低,过度冷却会凝固而堵塞导管.
 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓))}$CH2═CH2
CH2═CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.用少量的溴和足量的乙醇制各1,2-二溴乙烷的装置如图所示:
有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
(1)在此装置各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发d.减少副产物乙醚生成
(2)在装置C中应加入c,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该装置各反应已经结束的最简单方法是溴的颜色完全褪去;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);
(5)若产物中有少量副产物乙醚,可用蒸馏的方法除去;
(6)反应过程中应用冷水冷却装置D,其主要目的是避免溴大量挥发;但又不能过度冷却(如用冰水),其原因是产品1,2-二溴乙烷的沸点低,过度冷却会凝固而堵塞导管.