题目内容
6.下列各组中的离子,在溶液中能大量共存的是( )| A. | Ag+、H+、Cl-、CO32- | B. | H+、Ba2+、OH-、SO42- | ||
| C. | Ba2+、K+、Cl-、NO3- | D. | Ca2+、HCO3-、Cl-、OH- |
分析 A.银离子与氯离子、碳酸根离子反应,氢离子与碳酸根离子反应;
B.氢离子与氢氧根离子,钡离子与硫酸根离子反应;
C.四种离子之间不反应,能够共存;
D.碳酸氢根离子与氢氧根离子反应生成碳酸根离子,碳酸根离子与钙离子反应生成碳酸钙沉淀.
解答 解:A.Ag+与Cl-,Ag+、H+与CO32-之间发生反应,在溶液中不能大量共存,故A错误;
B.H+与OH-,Ba2+与SO42-之间反应,在溶液中不能大量共存,故B错误;
C.Ba2+、K+、Cl-、NO3-之间不发生反应,在溶液中能够大量共存,故C正确;
D.Ca2+、HCO3-、OH-之间反应生成碳酸钙沉淀,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的判断,题目难度中等,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间; 能发生氧化还原反应的离子之间等;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
16.设NA为阿伏加德罗常数,下列说法中错误的是( )
| A. | 含1molFeCl3 的饱和溶液最多可形成胶体粒子数为NA | |
| B. | 12克金属镁与足量的盐酸反应,转移电子数一定为NA(已知:Mg-2e-═Mg2+) | |
| C. | 10.6克Na2CO3晶体中含Na+数目为0.2NA | |
| D. | 常温常压下,22克CO2和0.5NA个CH4分子的体积是相等的 |
1.下列各组物质之间的化学反应,反应产物一定为纯净物的是( )
| A. |  → → | |
| B. | CH2═CH-CH2-CH3+HCl$→_{△}^{催化剂}$ | |
| C. | CH3-CH═CH2+H2O$→_{加热、加压}^{催化剂}$ | |
| D. | nCH2═CH2+nCH2═CH-CH3$→_{△}^{催化剂}$ |
11.下列说法中正确的是( )
| A. | 摩尔既是物质的数量单位又是物质的质量单位 | |
| B. | 常温常压下,48gO2所占的体积是33.6L | |
| C. | 阿伏加德罗常数的数值就是0.012kg12C中含有的碳原子数目 | |
| D. | 把1molNaCl溶于1L水中,所得溶液物质的量浓度为1mol/L |
18.在物质混合、反应等过程中,会存在“1+1≠2”的现象.通常情况下,下列各种混合或反应过程中,“1+1”不等于“2”的是( )
| A. | 1g酒精和1g水混合后的总质量 | |
| B. | 100mL酒精与100mL水混合均匀后所得溶液的总体积 | |
| C. | 温度一定时1gH2O溶解1g硝酸钾后,所得溶液的质量 | |
| D. | 1g氢氧化钠溶液和1g醋酸溶液混合后溶液的质量 |
15.将一定量的金属钠放入一定浓度的氢氧化钠溶液中,反应完全后,恢复到原温度,氢氧化钠的浓度( )
| A. | 增大 | B. | 减小 | C. | 不变 | D. | 不能确定 |
16.下列说法不正确的是( )
| A. | 蛋白质溶液中加入饱和硫酸铵溶液后产生的沉淀能重新溶于水 | |
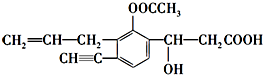
| B. | CH2=CH-CH(CH3)-C≡CH经催化加氢可生成3-甲基戊烷 | |
| C. | 当人误食重金属盐类时,可以喝大量的牛奶、蛋清解毒 | |
| D. | 已知苹果酸的结构简式为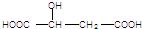 ,则该物质可发生氧化反应、酯化反应、缩聚反应,与HOOC-CH2-CH(OH)-COOH互为同分异构体 ,则该物质可发生氧化反应、酯化反应、缩聚反应,与HOOC-CH2-CH(OH)-COOH互为同分异构体 |