题目内容
【题目】某课外活动小组用如图装置进行实验,试回答下列问题:
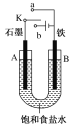
(1)若开始时开关K与a连接,则A极的电极反应式为____________________B极的Fe发生__________ 腐蚀(填“析氢”或“吸氧”)
(2)若开始时开关K与b连接,下列说法正确的是________(填序号)
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
(3)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
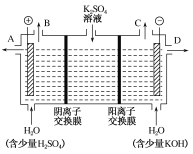
①该电解槽的阳极反应式为______________,此时通过阴离子交换膜的离子数________(填“大于”“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口________(填“A”“B”“C”或“D”)导出。
【答案】O2+2H2O+4e-=4OH- 吸氧 ② 4OH--4e-=2H2O+O2↑(或4H2O-4e-= O2↑+4H+) 小于 D
【解析】
(1)开始时开关K与a连接形成原电池反应,B极铁电极作负极,发生氧化反应,A电极石墨作正极,中性溶液中氧气得到电子生成氢氧根离子;
(2)开始时开关K与b连接形成电解池,与电源正极相连的A电极为阳极,溶液中氯离子失电子生成氯气,与电源负极相连的B电极为电解池的阴极,溶液中氢离子得到电子生成氢气,电解氯化钠溶液生成氢氧化钠、氢气和氯气。恢复到电解前电解质的浓度,“出什么加什么”的原则分析;
(3)①电解时,离子放电能力:OH->SO42-,在阳极上失电子发生氧化反应;根据阴阳离子的移动方向,通过相同电量时,阴阳离子交换的个数判断;
②电解产生的氢氧化钾在阴极产生。
(1)开始时开关K与a连接形成原电池反应,B电极铁电极作负极,失电子被氧化生成Fe2+,B电极反应为Fe-2e-=Fe2+;A电极石墨电极作正极,由于溶液为中性,所以是溶液中的氧气获得电子,发生还原反应,电极反应为:O2+2H2O+4e-=4OH-;Fe发生吸氧腐蚀;
(2)若开始时开关K与b连接,装置为电解池,A(石墨)电极是阳极,B(铁)电极为阴极。
①.电解过程中阳离子向阴极移动,B为阴极,溶液中Na+向B极移动,①错误;
②.A电极上溶液中的Cl-失去电子生成氯气,氯气有强的氧化性,能使湿润KI淀粉试纸变蓝,②正确;
③.电解的总反应方程式是:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,从溶液中析出的物质有H2、Cl2,所以要使溶液恢复到电解前电解质的浓度,反应一段时间后加适量HCl气体,不是加入盐酸,③错误;
2NaOH+H2↑+Cl2↑,从溶液中析出的物质有H2、Cl2,所以要使溶液恢复到电解前电解质的浓度,反应一段时间后加适量HCl气体,不是加入盐酸,③错误;
合理答案为②;
(3)①电解时,阳极上是溶液中的阴离子失电子,发生氧化反应,由于放电能力OH->SO42-,所以阳极上氢氧根离子失电子生成水和氧气4OH--4e-=2H2O+O2↑;阳极氢氧根离子放电,因此SO42-向阳极移动;阳离子放电能力:H+>Na+,所以阴极H+放电,因此Na+向阴极移动。当通过相同电量时,通过阴离子交换膜的离子数就小于通过阳离子交换膜的离子数;
②电解产生的氢氧化钾在阴极生成,所以氢氧化钾溶液从出口D流出。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】CO2是一种廉价的碳资源,其综合利用具有重要意义。回答下列问题:
(1)CO2可以被NaOH溶液捕获。若所得溶液pH=13,CO2主要转化为__________(写离子符号);若所得溶液pH=10,溶液中c(HCO3-)∶c(CO32-)__________。(室温下,H2CO3的K1=4×10-7;K2=5×10-11)
(2)CO2与CH4经催化重整不仅可以制得合成气,还对温室气体的减排具有重要意义。催化重整反应为:CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。
已知:C(s)+2H2(g)=CH4(s) △H=-75kJ·mol-1
C(s)+O2(g)=CO2(s) △H=-394kJ·mol-1
C(s)+ ![]() O2(g)=CO(s) △H=-111kJ·mol-1
O2(g)=CO(s) △H=-111kJ·mol-1
①该催化重整反应的△H=__________。有利于提高CH4平衡转化率的条件是__________(填标号)。
A 低温低压 B 低温高压 C 高温低压 D 高温高压
某温度下,在体积为2L的容器中加入2mol CH4、1molCO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为__________mol2·L-2。
②反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如下表:
积碳反应 CH4(g)= C(s)+ 2H2(g) | 消碳反应 CO2(g)+C(s)=2CO(g) | ||
△H/kJ·mol-1 | 75 | 172 | |
活化能/kJ·mol-1 | 催化剂X | 33 | 91 |
催化剂Y | 43 | 72 | |
由上表判断,催化剂X__________Y(填“优于”或“劣于”),理由是:__________________。
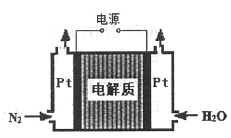
(3)在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示:
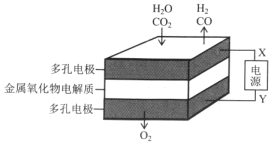
①X是电源的__________极(填“正”或“负”)。
②阴极的电极反应式是:H2O+2e-=H2+O2- 、CO2+2e-=CO+O2-
则总反应可表示为__________。
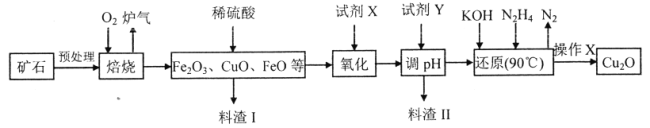
【题目】氧化亚铜(Cu2O)是一种用途广泛的光电材料,某工厂以硫化铜矿石(含CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:
常温下几种物质开始形成沉淀与完全沉淀时的pH如下表
Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀 | 7.5 | 2.7 | 4.8 |
完全沉淀 | 9.0 | 3.7 | 6.4 |
(1)炉气中的有害气体成分是__________,Cu2S与O2反应时,氧化剂与还原剂的物质的量之比为__________。
(2)若试剂X是H2O2溶液,写出相应反应的离子方程式:__________。并写出H2O2的电子式__________,Fe(铁)在元素周期表中的位置:__________;当试剂X是__________时,更有利于降低生产成本。
(3)加入试剂Y调pH时,pH的调控范围是__________。
(4)操作X包括__________、洗涤、烘干,其中烘干时要隔绝空气,其目的是__________。
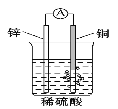
(5)以铜与石墨作电极,电解浓的强碱性溶液可制得纳米级Cu2O,写出阳极上生成Cu2O的电极反应式:__________。
【题目】在10L 恒容密闭容器中充入X(g)和Y(g),发生:X(g)+Y(g)![]() M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
实验 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(X) | n(Y) | n(M) | ||
① | 700 | 0.40 | 0.10 | 0.090 |
② | 800 | 0.10 | 0.40 | 0.080 |
③ | 800 | 0.20 | 0.30 | a |
④ | 900 | 0.10 | 0.15 | b |
下列说法中不正确的是
A. 实验①中,若5min时测得n(M)=0.050mol,则0至5min时间内,用N表示的平均反应速率v(N)=1.0×10-3mol/(L·min)
B. 实验④中,达到平衡时,b>0.060
C. 实验③中,达到平衡时,X的转化率为60%
D. 实验②中,该反应的平衡常数K=1.0