题目内容
【题目】氮是一种重要的元素,其对应化合物在生产生活中有重要的应用。
(1)氮化铝(AlN)可用于制备耐高温的结构陶瓷,遇强碱会腐蚀,写出AlN与氢氧化钠溶液反应的离子方程式_______________。
(2)氨是制备氮肥、硝酸等的重要原料②③
①己知:N2(g)+3H2(g) ![]() 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
N2(g)+O2(g) ![]() 2NO(g) △H=+180 kJ/mol
2NO(g) △H=+180 kJ/mol
2H2(g)+O2(g) ![]() 2H2O(1) △H= -571.6 kJ/mol
2H2O(1) △H= -571.6 kJ/mol
试写出表示氨的标准燃烧热的热化学方程式________________。
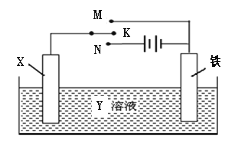
②某电解法制氨的装置如右图所示,电解质只允许质子通过,试写出阴极的电极反应式__________。

(3)反应:2NO(g)+O2(g)![]() 2NO2(g)△H<0是制备硝酸过程中的一个反应。
2NO2(g)△H<0是制备硝酸过程中的一个反应。
①将NO和O2按物质的量之比为2:1置于恒温恒容密闭容器中进行上述反应,得到NO2体积分数与时间的关系如下图所示。保持其它条件不变,t1时再向容器中充入适量物质的量之比为2:1的NO和O2的混合气体,t2时再次达到平衡,请画出tl-t3时间范围内NO2体积分数随时间的变化曲线:____________。

②在研究此反应速率与温度的关系时发现,NO转化成NO2的速率随温度升高反而减慢。进一步研究发现,上述反应实际是分两步进行的:
I 2NO(g) ![]() N2O2(g) △H<0
N2O2(g) △H<0
II N2O2(g)+O2(g) ![]() 2NO2(g) △H<0
2NO2(g) △H<0
已知反应I能快速进行,试结合影响化学反应速率的因素和平衡移动理论分析,随温度升高,NO转化成NO2的速率减慢的可能原因________。
(4)已知常温下,Ka(CH3COOH)=Kb(NH3·H2O)=l.8×l0-5。则常温下0.lmol/L的CH3COONH4溶液中,(CH3COO-):c(NH3·H2O)=________________。
【答案】AlN+H2O+OH-=AlO2-+NH3↑NH3(g)+3/4O2(g)=1/2N2(g)+3/2H2O(l) △H=-382.5kJ/molN2十6H++6e-=2NH3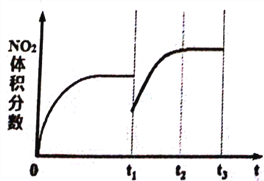 当温度升高时,反应(I)向逆反应方向进行,且由于反应I进行速率相当快,瞬间达到平衡,使得体系中c(N2O2)浓度迅速减小,所以反应(II),速率减慢180
当温度升高时,反应(I)向逆反应方向进行,且由于反应I进行速率相当快,瞬间达到平衡,使得体系中c(N2O2)浓度迅速减小,所以反应(II),速率减慢180
【解析】(1)本题考查离子方程式的书写,利用元素及其化合物知识入手,反应方程式为AlN+NaOH+H2O=NaAlO2+NH3↑,其离子反应方程式为:AlN+H2O+OH-=AlO2-+NH3↑ ;(2)①本题考查热化学反应方程式的计算,从盖斯定律入手,①N2(g)+3H2(g) ![]() 2NH3(g),②2H2(g)+O2(g)
2NH3(g),②2H2(g)+O2(g) ![]() 2H2O(1),氨气的燃烧热反应方程式为:NH3(g)+3/4O2(g)=1/2N2(g)+3/2H2O(l),②×3/4-①/2得出NH3(g)+3/4O2(g)=1/2N2(g)+3/2H2O(l) △H=(-571.6×3/4+92.4/2)kJ·mol-1=-382.5kJ·mol-1 ;②本题考查电解池中电极反应式的书写,电解池是制取NH3,N2的化合价由0价→-3价,化合价降低,得到电子,即左端为阴极,右端为阳极,电解质只允许质子通过,因此阴极反应式为:N2十6H++6e-=2NH3;(3)①本题考查影响化学平衡的移动,再通入2:1的NO和O2,瞬间NO2体积分数降低,平衡向正反应方向移动,NO2的体积分数增大,即图像是:
2H2O(1),氨气的燃烧热反应方程式为:NH3(g)+3/4O2(g)=1/2N2(g)+3/2H2O(l),②×3/4-①/2得出NH3(g)+3/4O2(g)=1/2N2(g)+3/2H2O(l) △H=(-571.6×3/4+92.4/2)kJ·mol-1=-382.5kJ·mol-1 ;②本题考查电解池中电极反应式的书写,电解池是制取NH3,N2的化合价由0价→-3价,化合价降低,得到电子,即左端为阴极,右端为阳极,电解质只允许质子通过,因此阴极反应式为:N2十6H++6e-=2NH3;(3)①本题考查影响化学平衡的移动,再通入2:1的NO和O2,瞬间NO2体积分数降低,平衡向正反应方向移动,NO2的体积分数增大,即图像是: ;②本题考查影响化学反应速率和化学平衡的因素,当温度升高时,反应(I)向逆反应方向进行,且由于反应I进行速率相当快,瞬间达到平衡,使得体系中c(N2O2)浓度迅速减小,所以反应(II),速率减慢,所以NO转化成NO的速率减慢;(4)因为CH3COOH和NH3·H2O电离平衡常数相同,因此CH3COO-和NH4+水解程度相同,即CH3COOH和NH3·H2O的浓度相同,溶液显中性, c(CH3COO-)×c(H+)/c(CH3COOH)=Ka,c(CH3COO-)/c(NH3·H2O)=Ka/c(H+)=1.8×10-5/10-7=180。
;②本题考查影响化学反应速率和化学平衡的因素,当温度升高时,反应(I)向逆反应方向进行,且由于反应I进行速率相当快,瞬间达到平衡,使得体系中c(N2O2)浓度迅速减小,所以反应(II),速率减慢,所以NO转化成NO的速率减慢;(4)因为CH3COOH和NH3·H2O电离平衡常数相同,因此CH3COO-和NH4+水解程度相同,即CH3COOH和NH3·H2O的浓度相同,溶液显中性, c(CH3COO-)×c(H+)/c(CH3COOH)=Ka,c(CH3COO-)/c(NH3·H2O)=Ka/c(H+)=1.8×10-5/10-7=180。

 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案