题目内容
17.X、Y、Z、M、W为五种短周期元素.X原子的质子数与电子层数相同,W原子核外电子数是M原子最外层电子数的2倍,Y、Z、M、W在周期表中的相对位置如图所示.下列说法不正确的是( )| Y | Z | M | |
| W |
| A. | 原子半径:W>Y>Z>M>X | |
| B. | 热稳定性:XM>X2Z,沸点:X2Z>YX3 | |
| C. | X、Y、Z三种元素形成的化合物中不可能含离子键 | |
| D. | ZM2、YM3、WM4分子中每个原子最外层均满足8电子结构 |
分析 X、Y、Z、M、W为5种短周期元素,X的质子总数与电子层数相同,则X为H元素;
Y、Z、M同周期且相邻,W原子核外电子数是M原子最外层电子数的2倍,则Z为O元素,可推知Y为N元素、M为F元素、W为Si,据此判断即可.
解答 解:X、Y、Z、M、W为5种短周期元素,X的质子总数与电子层数相同,则X为H元素;
Y、Z、M同周期且相邻,W原子核外电子数是M原子最外层电子数的2倍,则Z为O元素,可推知Y为N元素、M为F元素、W为Si,
综上所述:X为氢、Y为氮、Z为氧、M为氟、W为硅;
A.同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径Si>N>O>F>H,故A正确;
B.XM为HF,X2Z为H2O,元素的非金属性越强,其气态氢化物越稳定,由于非金属性F>O,故HF>H2O正确;水中含有氢键,O-H键长短与N-H,故沸点:H2O>NH3,故B正确;
C.H、N、O三种元素形成的化合物可以是硝酸铵,硝酸铵中既有离子键又有共价键,故C错误;
D.ZM2、YM3、WM4分别为OF2、NH3、SiF4,此三种物质每个原子最外层均满足8电子结构,故D正确,
故选C.
点评 本题考查结构性质位置关系应用,难度中等,推断元素是解题关键,注意氢键键能大小比较.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.利用下列有关实验装置进行的相应实验,能达到实验目的是( )
| A. | 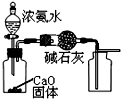 制取并收集干燥的NH3 | |
| B. | 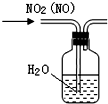 可除去NO2中的NO | |
| C. | 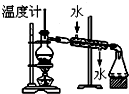 分离两种互溶但沸点相差较大的液体混合物 | |
| D. | 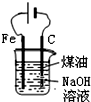 制备Fe(OH)2并能较长时间观察其颜色 |
12.下列有关化学用语表示正确的是( )
| A. | 氟原子的结构示意图: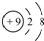 | |
| B. | 邻硝基甲苯的结构简式: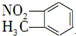 | |
| C. | 质子数为27、中子数为33的Co原子:${\;}_{27}^{60}$Co | |
| D. | H2O2的电子式: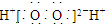 |
2.在探究SO2性质的实验中,下列说法正确的是( )
| A. | SO2气体通入NaOH溶液中,产生倒吸现象,说明SO2极易溶于水 | |
| B. | SO2气体通入溴水中,溴水的颜色褪去,说明SO2具有漂白性 | |
| C. | SO2气体通入酸性KMnO4溶液中,溶液的颜色变浅,说明SO2具有还原性 | |
| D. | SO2气体通入Ba(NO3)2溶液中,溶液出现浑浊现象,说明有BaSO3沉淀生成 |
9.下列指定反应的离子方程式书写正确的是( )
| A. | 用白醋除铁锈:Fe2O3•xH2O+6H+═(3+x)H2O+2Fe3+ | |
| B. | 向Ba(OH)2溶液中加入少量的NH4HSO4溶液:Ba2++2OH-+N${{H}_{4}}^{+}$+H++S${{O}_{4}}^{2-}$═BaSO4↓+NH3•H2O+H2O | |
| C. | 纯碱溶液和苯酚反应:C${{O}_{3}}^{2-}$+2C6H5OH→2C6H5O-+CO2↑+H2O | |
| D. | 用过氧化氢从酸化的海带灰浸出液中提取碘:2I-+H2O2═I2+2OH- |
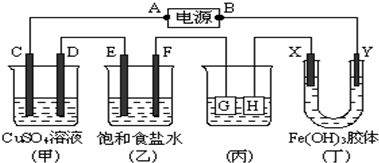
 ;
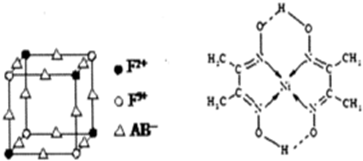
;
 现代世界产量最高的金属是Fe、Al、Cu.
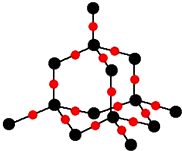
现代世界产量最高的金属是Fe、Al、Cu. )分子中碳原子杂化类型为SP2,分子中σ键比π键多5个.
)分子中碳原子杂化类型为SP2,分子中σ键比π键多5个.