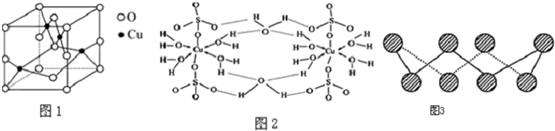
题目内容
7. 现代世界产量最高的金属是Fe、Al、Cu.
现代世界产量最高的金属是Fe、Al、Cu.(1)Fe、Al、Cu三种元素第一电离能由高到低的排序为Cu、Fe、Al;Fe2+的电子排布式为1s22s22p63s23p63d6.
(2)Cu(OH)2溶于浓氨水形成深蓝色铜氨溶液;乙二酸(
 )分子中碳原子杂化类型为SP2,分子中σ键比π键多5个.
)分子中碳原子杂化类型为SP2,分子中σ键比π键多5个.(3)以下变化伴随化学键破坏的是BCD(填下列选项标号)
A.冰融化 B.铝气化 C.AlCl3溶于水 D.胆矾受热变白
(4)二氧化硅晶体结构示意图如图,每个氧原子最近且等距离相邻6个氧原子.
分析 (1)金属性越强,越易失去一个电子,则第一电离能越小;Fe是26元素,核外电子数为26,失去2个电子形成Fe2+,根据核外电子排布规律书写;
(2)氢氧化铜与氨水发生络合反应,生成可溶性络合物;根据C原子的价层电子对数判断,单键只含有1个σ键,双键含有1个σ键和1个π键;
(3)A.冰融化破坏分子间作用力;
B.铝气化破坏金属键;
C.AlCl3溶于水发生电离;
D.胆矾受热变白破坏共价键.
(4)每个O原子连接2个Si原子,这2个Si原子除了连接该O原子外,还各连接3个O原子.
解答 解:(1)金属性越强,越易失去一个电子,则第一电离能越小,金属性:Al>Fe>Cu,则第一电离能由高到低的排序为Cu、Fe、Al;Fe是26元素,核外电子数为26,失去2个电子形成Fe2+,则Fe2+的核外电子排布式为1s22s22p63s23p63d6,
故答案为:Cu、Fe、Al;1s22s22p63s23p63d6;
(2)Cu(OH)2溶于氨水发生反应离子方程式:Cu(OH)2+4NH3H2O=[Cu(NH3)4]2++2OH-+4H2O,形成深蓝色溶液;乙二酸( )分子中碳原子的价层电子对数3,则杂化类型为sP2;分子中含有2个C=O和2个C-O,2个O-H,1个C-C,则共有7个σ键,2个π键,所以分子中σ键比π键多5个;
)分子中碳原子的价层电子对数3,则杂化类型为sP2;分子中含有2个C=O和2个C-O,2个O-H,1个C-C,则共有7个σ键,2个π键,所以分子中σ键比π键多5个;
故答案为:深蓝;sP2;5;
(3)A.冰融化破坏分子间作用力,分子间作用力不是化学键;
B.铝气化破坏金属键,金属键属于化学键;
C.AlCl3溶于水发生电离,破坏了共价键,共价键属于化学键;
D.胆矾受热变白破坏共价键,共价键属于化学键;
所以变化伴随化学键破坏的是BCD;
故答案为:BCD;
(4)每个O原子连接2个Si原子,这2个Si原子除了连接该O原子外,还各连接3个O原子,则2个Si原子另外连接了6个O原子,所以每个氧原子最近且等距离相邻6个O原子;
故答案为:6.
点评 本题考查核外电子排布规律、电离能、化学键、晶胞计算等,难度中等,注意把握共价键的分类以及σ键和π键数目的判断方法.

 阅读快车系列答案
阅读快车系列答案| Y | Z | M | |
| W |
| A. | 原子半径:W>Y>Z>M>X | |
| B. | 热稳定性:XM>X2Z,沸点:X2Z>YX3 | |
| C. | X、Y、Z三种元素形成的化合物中不可能含离子键 | |
| D. | ZM2、YM3、WM4分子中每个原子最外层均满足8电子结构 |
| A. | 该溶液中,K+、Cl-、HCOOH、I-可以大量共存 | |
| B. | 与Na2SO3反应的离子方程式:ClO-+SO32-═SO42-+Cl- | |
| C. | 不可使用pH试纸测定该溶液的pH | |
| D. | 1 L 0.1 mol/L该溶液和足量的CO2充分反应,产生10 g沉淀 |
| A. | 0.1 mol•L-1的硫酸溶液:NH4+、Fe2+、Cl-、NO3- | |
| B. | pH=12的溶液K+、Na+、CH3COO-、Br- | |
| C. | 与铝反应产生大量氢气的溶液:K+、NH4+、HCO3-、Cl- | |
| D. | 酚酞呈红色的溶液:Na+、Fe2+、Cl-、SO42- |
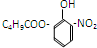
| A. | 按系统命名法,化合物(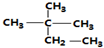 )的名称为2-甲基-2-乙基丙烷 )的名称为2-甲基-2-乙基丙烷 | |
| B. | 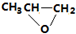 和CO2转化为 和CO2转化为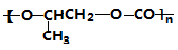 的反应符合绿色化学的原则 的反应符合绿色化学的原则 | |
| C. | 用新制氢氧化铜悬浊液无法检验失去标签的乙醇、乙醛、乙酸三瓶无色溶液 | |
| D. | 乙醇和乙醚互为同分异构体,沸点乙醇比乙醚高 |
 满足的有机物,下列描述中正确的是( )
满足的有机物,下列描述中正确的是( )| A. | 分子中有2种含氧官能团 | B. | 能发生取代、加成、消去、氧化反应 | ||
| C. | 1mol该有机物最多消耗3mol NaOH | D. | 苯环上的一溴代物最多有3种 |
 如图装置中,容器甲内充入0.1mol NO气体.干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体.恒温下,容器甲中活塞缓慢由D处向左移动,当移至C处时容器体积缩至最小,为原体积的$\frac{9}{10}$,干燥管中物质的质量增加了2.24g.随着CO2的继续通入,活塞又逐渐向右移动.下列说法中正确的是( )
如图装置中,容器甲内充入0.1mol NO气体.干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体.恒温下,容器甲中活塞缓慢由D处向左移动,当移至C处时容器体积缩至最小,为原体积的$\frac{9}{10}$,干燥管中物质的质量增加了2.24g.随着CO2的继续通入,活塞又逐渐向右移动.下列说法中正确的是( )| A. | 活塞从D处移动到C处的过程中,通入的CO2气体为2.24 L (标准状况) | |
| B. | NO2转化为N2O4的转化率为20% | |
| C. | 容器甲中NO已反应完 | |
| D. | 活塞移至C处后,继续通入a mol CO2,此时活塞恰好回至D处,则a小于0.01 |