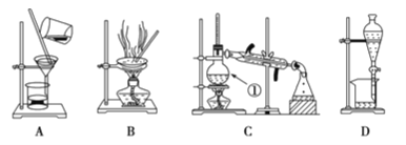
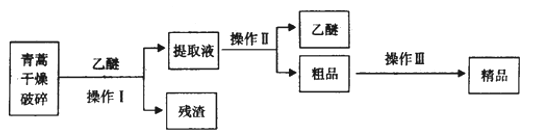
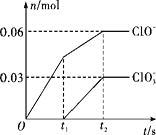
题目内容
【题目】铅蓄电池的电极材料分别为Pb和PbO2,电解质溶液为30% H2SO4。下图是处于工作状态的铅蓄电池示意图,若两电极的质量都增加且a极增加得更多。下列说法正确的是

A. a为铅蓄电池的正极
B. b电极发生的反应为PbO2+4H++SO42-+2e-=PbSO4+2H2O
C. 该铅蓄电池正在充电
D. 工作一段时间后,溶液的pH不断减小
【答案】B
【解析】放电时负极电极反应为Pb-2e-+SO42-=PbSO4,正极电极反应为PbO2+2e-+4H++SO42-=PbSO4+2H2O,可知正极质量增加的多,则a为Pb,做负极,A错误;b为正极,正极电极反应PbO2+2e-+4H++SO42-=PbSO4+2H2O,B正确;铅蓄电池的电极材料分别为Pb和PbO2,放电时负极反应式为Pb-2e-+![]()
![]() PbSO4,负极质量增加;正极反应式为PbO2+2e-+4H++
PbSO4,负极质量增加;正极反应式为PbO2+2e-+4H++![]()
![]() PbSO4+2H2O,正极质量也增加,但经过相同时间后负极增加的质量较多,故a极为负极,b极为正极,电池总反应为Pb+PbO2+2H2SO4
PbSO4+2H2O,正极质量也增加,但经过相同时间后负极增加的质量较多,故a极为负极,b极为正极,电池总反应为Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O。由此可知该铅蓄电池正在放电,C错误;由Pb+PbO2+2H2SO4=2PbSO4↓+2H2O可知,氢离子浓度减小,pH增大,D错误;正确选项B。
2PbSO4+2H2O。由此可知该铅蓄电池正在放电,C错误;由Pb+PbO2+2H2SO4=2PbSO4↓+2H2O可知,氢离子浓度减小,pH增大,D错误;正确选项B。

 阅读快车系列答案
阅读快车系列答案【题目】2SO2(g)+ O2(g) ![]() 2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断正确的是
2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断正确的是
甲 | 乙 | 丙 | ||
起始物质的量 | n(SO2)/mol | 0.4 | 0.8 | 0.8 |
n(O2)/mol | 0.24 | 0.24 | 0.48 | |
SO2的平衡转化率/% | 80 | α1 | α2 |
A. 甲中反应的平衡常数小于乙
B. 该温度下,平衡常数值为400
C. 平衡时,丙中c(SO3)是甲中的2倍
D. 平衡时,甲中O2的转化率大于乙中O2的转化率