题目内容
【题目】一氧化碳是一种用途广泛的化工基础原料。有机物加氢反应中镍是常用的催化剂。但H2中一般含有微量CO会使催化剂镍中毒,在反应过程中消除CO的理想做法是投入少量SO2,为弄清该方法对催化剂的影响,查得资料如下:

则:(1)① 不用通入O2氧化的方法除去CO的原因是 ______________________________。
②SO2(g)+2CO(g)===S(s)+2CO2(g) ΔH=________。
(2)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O(g) ![]() CO2(g)+H2(g),已知420 ℃时,该反应的化学平衡常数K=9。如果反应开始时,在2 L的密闭容器中充入CO和H2O的物质的量都是0.60 mol,5 min末达到平衡,则此时CO的转化率为________,H2的平均生成速率为________ mol·L-1·min-1。
CO2(g)+H2(g),已知420 ℃时,该反应的化学平衡常数K=9。如果反应开始时,在2 L的密闭容器中充入CO和H2O的物质的量都是0.60 mol,5 min末达到平衡,则此时CO的转化率为________,H2的平均生成速率为________ mol·L-1·min-1。
(3)为减少雾霾、降低大气中有害气体含量, 研究机动车尾气中CO、NOx及CxHy的排放量意义重大。机动车尾气污染物的含量与空/燃比 (空气与燃油气的体积比)的变化关系示意图如图所示:
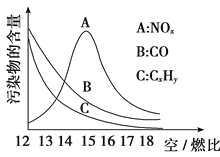
①随空/燃比增大,CO和CxHy的含量减少的原因是_____________________________。
②当空/燃比达到15后,NOx减少的原因可能是____________________________________________。
【答案】 Ni会与氧气反应 -270.0 kJ·mol-1 75% 0.045 空/燃比增大,燃油气燃烧更充分,故CO、CxHy含量减少 因为反应N2(g)+O2(g) ![]() 2NO(g)是吸热反应,当空/燃比大于15后,由于燃油气含量减少,燃油气燃烧放出的热量相应减少,环境温度降低,使该反应不易进行,故NOx减少
2NO(g)是吸热反应,当空/燃比大于15后,由于燃油气含量减少,燃油气燃烧放出的热量相应减少,环境温度降低,使该反应不易进行,故NOx减少
【解析】(1)①由于Ni能与氧气反应也会导致其中毒,所以不用通入O2氧化的方法除去CO;②由图Ⅰ可知,(ⅰ)O2(g)+2CO(g)===2CO2(g) ΔH=(-2×283)kJ·mol-1=-566 kJ·mol-1,由图Ⅱ可知,(ⅱ)S(s)+O2(g)===SO2(g) ΔH=-296 kJ·mol-1,根据哥斯达黎加(ⅰ)-(ⅱ)得:SO2(g)+2CO(g)===S(s)+2CO2(g) ΔH=[-566-(-296)] kJ·mol-1=-270 kJ·mol-1;(2)设参加反应的CO的浓度为x,则
CO(g) + H2O(g) ![]() CO2(g)+H2(g)
CO2(g)+H2(g)
起始浓度(mol·L-1) 0.30 0.30 0 0
转化浓度(mol·L-1) x x x x
平衡浓度(mol·L-1) 0.30-x 0.30-x x x
K=9.0=![]() ,解得x=0.225,所以CO的转化率α(CO)=0.225/0.3×100%=75%,氢气的生成速率v(H2)=0.225mol/L÷5min=0.045 mol·L-1·min-1;(3)①由于空/燃比增大,燃油气燃烧更充分,所以CO、CxHy含量减少;②反应N2(g)+O2(g)
,解得x=0.225,所以CO的转化率α(CO)=0.225/0.3×100%=75%,氢气的生成速率v(H2)=0.225mol/L÷5min=0.045 mol·L-1·min-1;(3)①由于空/燃比增大,燃油气燃烧更充分,所以CO、CxHy含量减少;②反应N2(g)+O2(g)![]() 2NO(g)是吸热反应,当空/燃比大于15后,由于燃油气含量减少,燃油气燃烧放出的热量相应减少,环境温度降低,使该反应不易进行,所以NOx减少。
2NO(g)是吸热反应,当空/燃比大于15后,由于燃油气含量减少,燃油气燃烧放出的热量相应减少,环境温度降低,使该反应不易进行,所以NOx减少。

 阅读快车系列答案
阅读快车系列答案【题目】减少氮氧化物和硫氧化物在大气 中的共放是环境保护的重要内容之一。
(1).已知:N2(g)+O2(g)=2NO (g) △H=+180.5kJ/mol
C(s )+ O2(g)=CO2(g) △H =-393.5kJ/mo1
2C(s)+ O2(g) =2CO(g) △H=-221kJ/mol
若某反应平衡常数表达式为: k=[c(N2)·c2(CO2)]/[c2(NO)·c2(CO)],请写出此反应的热化学方式________________________。
(2)N2O4在一定条件下可发生分解: 2 N2O5(g)![]() 4NO2(g) +O2 (g)。某温度下测得恒容密闭容器中N2O4浓度随时间的变化如下表:
4NO2(g) +O2 (g)。某温度下测得恒容密闭容器中N2O4浓度随时间的变化如下表:
t /min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
c(N0)/(mol/L) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
①反应开始时体系压强为P0第3.00min时体系压强为P1,则P1:P0 =__________2.00min~5.00min 内,O2的平均反应速率为________________。
②一定温度下,在恒容密闭容器充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是________。
a.容器中压强不再变化 b.NO2和O2 的体积比保持不变
c.2V正( NO2)=v逆(N2O5) d.气体的平均相对分子质量为43.2.且保持不变
(3)活性炭还原NO2的反应为: 2NO2(g)+2C (s)![]() N2(g)+2CO2(g),在恒温条件下,1mo1NO2和足量活性炭发生该反应,测得平衡时NO2和CO2的物质量浓度与平衡总压的关系如图所示:①A、B、C 三点中NO2的转化率最高约是_____点(填“A”、“B”或“C”)。
N2(g)+2CO2(g),在恒温条件下,1mo1NO2和足量活性炭发生该反应,测得平衡时NO2和CO2的物质量浓度与平衡总压的关系如图所示:①A、B、C 三点中NO2的转化率最高约是_____点(填“A”、“B”或“C”)。
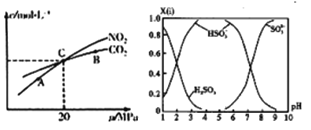
②计算C点时该反应的压强平衡常数Kp=_________MPa (K用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)直接排放含SO2的烟气会形成酸雨,危害环境。可月NaOH吸收,所得含硫各微粒(H2SO3 、HSO3-利SO32- )存在于反应后的溶被中,它们的物质量分数X(i)与溶液pH的关系如图所示。
若是与0.lmol/LNaOH 反应后的溶液,现得溶液为pH=8时,溶液中各离子浓度由大到小的顺序是____________________。
(5)实验狈得NH4HSO3溶液中,![]() ,则溶液的pH为_____;向该溶液中加氨水使溶液呈中性时,
,则溶液的pH为_____;向该溶液中加氨水使溶液呈中性时,![]() =______________。(已知: H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)。
=______________。(已知: H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)。