题目内容
9.下列气体所含分子数最多的是( )| A. | 10.0g C2H6 | B. | 标准状况下5.6L 空气 | ||
| C. | 1.0mol/L溶液中HCl | D. | 3.01×1023 个臭氧分子 |
分析 根据n=$\frac{m}{M}$计算C2H6物质的量,根据n=$\frac{V}{{V}_{m}}$计算空气物质的量,根据n=$\frac{N}{{N}_{A}}$计算臭氧物质的量,溶液中没有HCl分子,物质的量越大,分子数目越多.
解答 解:10g C2H6物质的量为$\frac{10g}{30g/mol}$=0.33mol,标况下5.6L 空气物质的量为$\frac{5.6L}{22.4L/mol}$=0.25mol,3.01×1023 个臭氧分子物质的量为0.5mol,盐酸溶液中没有HCl分子,故3.01×1023 个臭氧分子数目最多,
故选:D.
点评 本题考查物质的量有关计算,比较基础,旨在考查学生对基础知识的巩固.

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案
相关题目
1. 乙二酸( HOOC-COOH)俗称草酸,它广泛分布于植物的茎叶中.为了探究乙二酸的性质.某化学兴趣小组设计了如下实验,试根据所给信息,回答有关问题:
乙二酸( HOOC-COOH)俗称草酸,它广泛分布于植物的茎叶中.为了探究乙二酸的性质.某化学兴趣小组设计了如下实验,试根据所给信息,回答有关问题:
I.乙二酸的弱酸性:
查数据可知(25℃):
(1)H2C2O4的电离方程式为H2C2O4?H++HC2O4-、HC2O4-?H++C2O42-.
(2)向盛有饱和NaHCO3溶液的试管里加入少量草酸溶液,可观察到有无色气泡产生,该反应的离子方程式为2HCO3-+H2C2O4=C2O42-+2H2O+2CO2↑.
(3)该小组同学将0.1mol•L-1草酸溶液和0.1mol•L-1的NaOH等体积混合后,测定反应后溶液呈酸性,则所得溶液中各离子浓度由大到小的顺序为c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-).
(4)为验证草酸具有弱酸性设计了下列实验,其中能达到实验目的是AD.
A.测0.1mol•L-1草酸溶液的pH B.将草酸溶液加入Na2CO3溶液中,有CO2放出
C.将草酸晶体溶于含酚酞的NaOH溶液中,溶液褪色 D.测草酸钠溶液的pH
Ⅱ.一定温度下,草酸晶体加水稀释过程中溶液的导电能力曲线如图所示:
(1)下列有关草酸稀释的说法正确的是A
A.a、b、c三点草酸的电离程度:a<b<c
B.a、b、c三点溶液的pH:c<a<b
C.用湿润的pH试纸测量a处溶液的pH,测量结果偏大
D.a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:c<a<b
(2)在上述稀释过程中,始终保持增大趋势的是BD
A.溶液PH值 B.草酸电离度α C.c(H+)•c(OH-) D.C2O42-个数
Ⅲ.已知草酸的钠盐和钾盐易溶于水,而其钙盐却难溶于水.查数据可知:CaCO3、CaC2O4的溶度积常数Ksp(25℃)分别为5.0×10-9、2.5×10-9,向0.6mol•L-1Na2C2O4溶液中加入过量CaCO3固体后,溶液中的c(CO32-)=0.4mol/L.
 乙二酸( HOOC-COOH)俗称草酸,它广泛分布于植物的茎叶中.为了探究乙二酸的性质.某化学兴趣小组设计了如下实验,试根据所给信息,回答有关问题:
乙二酸( HOOC-COOH)俗称草酸,它广泛分布于植物的茎叶中.为了探究乙二酸的性质.某化学兴趣小组设计了如下实验,试根据所给信息,回答有关问题:I.乙二酸的弱酸性:
查数据可知(25℃):
| 弱酸 | 电离常数 | 弱酸 | 电离常数 |
| H2CO3 (碳酸) | K1=4.4×10-7 | H2C2O4 (草酸) | K1=5.4×10-2 |
| K2=4.7×10-11 | K2=5.4×10-5 |
(2)向盛有饱和NaHCO3溶液的试管里加入少量草酸溶液,可观察到有无色气泡产生,该反应的离子方程式为2HCO3-+H2C2O4=C2O42-+2H2O+2CO2↑.
(3)该小组同学将0.1mol•L-1草酸溶液和0.1mol•L-1的NaOH等体积混合后,测定反应后溶液呈酸性,则所得溶液中各离子浓度由大到小的顺序为c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-).
(4)为验证草酸具有弱酸性设计了下列实验,其中能达到实验目的是AD.
A.测0.1mol•L-1草酸溶液的pH B.将草酸溶液加入Na2CO3溶液中,有CO2放出
C.将草酸晶体溶于含酚酞的NaOH溶液中,溶液褪色 D.测草酸钠溶液的pH
Ⅱ.一定温度下,草酸晶体加水稀释过程中溶液的导电能力曲线如图所示:
(1)下列有关草酸稀释的说法正确的是A
A.a、b、c三点草酸的电离程度:a<b<c
B.a、b、c三点溶液的pH:c<a<b
C.用湿润的pH试纸测量a处溶液的pH,测量结果偏大
D.a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:c<a<b
(2)在上述稀释过程中,始终保持增大趋势的是BD
A.溶液PH值 B.草酸电离度α C.c(H+)•c(OH-) D.C2O42-个数
Ⅲ.已知草酸的钠盐和钾盐易溶于水,而其钙盐却难溶于水.查数据可知:CaCO3、CaC2O4的溶度积常数Ksp(25℃)分别为5.0×10-9、2.5×10-9,向0.6mol•L-1Na2C2O4溶液中加入过量CaCO3固体后,溶液中的c(CO32-)=0.4mol/L.
2.有铝片、铁片、铜片三种金属片,只利用下列某种试剂或方法无法将它们区别开的是( )
| A. | 盐酸 | B. | 醋酸 | C. | NaOH溶液 | D. | 观察法 |
17.下列说法正确的是( )
| A. | 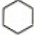 属于饱和烃 属于饱和烃 | |
| B. | 化合物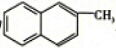 是苯的同系物 是苯的同系物 | |
| C. | 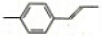 分子中碳原子一定共平面 分子中碳原子一定共平面 | |
| D. | 除甲酸外的羧酸均不能使酸性高锰酸钾溶液褪色 |
4.下列离子组一定能大量共存的是( )
| A. | 酚酞为无色的溶液:I-、CH3COO-、NO3-、Na+ | |
| B. | 甲基橙呈黄色的溶液中:Na+、CO32-、NO3-、NH4+ | |
| C. | 含大量Al3+的溶液中:K+、Na+、S2-、NO3- | |
| D. | pH>7的溶液中:CO32-、Cl-、F-、K+ |
1.下列说法正确的是( )
| A. | 明矾既可用于净水,也可杀菌消毒 | |
| B. | 溴乙烷与NaOH的乙醇溶液共热生成乙烯 | |
| C. | 糖类、油脂和蛋白质都是天然高分子化合物 | |
| D. | 用福尔马林(甲醛溶液)浸泡海产品,可长时间保鲜 |
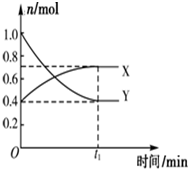 某温度下,在2L密闭容器中,发生NO2和N2O4之间的反应:N2O4(g)?2NO2(g),各物质的量随时间的变化关系如图所示,
某温度下,在2L密闭容器中,发生NO2和N2O4之间的反应:N2O4(g)?2NO2(g),各物质的量随时间的变化关系如图所示,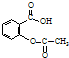 )与氢氧化钠反应可制得可溶性阿司匹林,疗效更好.写出阿司匹林与氢氧化钠的反应方程式
)与氢氧化钠反应可制得可溶性阿司匹林,疗效更好.写出阿司匹林与氢氧化钠的反应方程式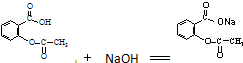 .
.