题目内容
1. 乙二酸( HOOC-COOH)俗称草酸,它广泛分布于植物的茎叶中.为了探究乙二酸的性质.某化学兴趣小组设计了如下实验,试根据所给信息,回答有关问题:
乙二酸( HOOC-COOH)俗称草酸,它广泛分布于植物的茎叶中.为了探究乙二酸的性质.某化学兴趣小组设计了如下实验,试根据所给信息,回答有关问题:I.乙二酸的弱酸性:
查数据可知(25℃):
| 弱酸 | 电离常数 | 弱酸 | 电离常数 |
| H2CO3 (碳酸) | K1=4.4×10-7 | H2C2O4 (草酸) | K1=5.4×10-2 |
| K2=4.7×10-11 | K2=5.4×10-5 |
(2)向盛有饱和NaHCO3溶液的试管里加入少量草酸溶液,可观察到有无色气泡产生,该反应的离子方程式为2HCO3-+H2C2O4=C2O42-+2H2O+2CO2↑.
(3)该小组同学将0.1mol•L-1草酸溶液和0.1mol•L-1的NaOH等体积混合后,测定反应后溶液呈酸性,则所得溶液中各离子浓度由大到小的顺序为c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-).
(4)为验证草酸具有弱酸性设计了下列实验,其中能达到实验目的是AD.
A.测0.1mol•L-1草酸溶液的pH B.将草酸溶液加入Na2CO3溶液中,有CO2放出
C.将草酸晶体溶于含酚酞的NaOH溶液中,溶液褪色 D.测草酸钠溶液的pH
Ⅱ.一定温度下,草酸晶体加水稀释过程中溶液的导电能力曲线如图所示:
(1)下列有关草酸稀释的说法正确的是A
A.a、b、c三点草酸的电离程度:a<b<c
B.a、b、c三点溶液的pH:c<a<b
C.用湿润的pH试纸测量a处溶液的pH,测量结果偏大
D.a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:c<a<b
(2)在上述稀释过程中,始终保持增大趋势的是BD
A.溶液PH值 B.草酸电离度α C.c(H+)•c(OH-) D.C2O42-个数
Ⅲ.已知草酸的钠盐和钾盐易溶于水,而其钙盐却难溶于水.查数据可知:CaCO3、CaC2O4的溶度积常数Ksp(25℃)分别为5.0×10-9、2.5×10-9,向0.6mol•L-1Na2C2O4溶液中加入过量CaCO3固体后,溶液中的c(CO32-)=0.4mol/L.
分析 I.(1)H2C2O4是二元弱酸,在溶液中部分电离,分两步电离;
(2)草酸的酸性强于碳酸,草酸与NaHCO3反应生成草酸钠和二氧化碳、水;
(3)二者恰好反应生成NaHC2O4,混合溶液呈酸性,则c(H+)>c(OH-),Na+不水解、HC2O4-水解,则c(Na+)>c(HC2O4-),溶液呈酸性说明HC2O4-电离程度大于水解程度,据此判断离子浓度大小;
(4)A.测定0.1molL-1草酸溶液的pH,根据氢离子浓度和草酸浓度相对大小判断电解质强弱;
B.将草酸溶液加入Na2CO3溶液中,有CO2放出,说明草酸酸性大于碳酸;
C.将草酸晶体溶于含酚酞的NaOH溶液中,溶液褪色,说明草酸具有酸性;
D.测定草酸钠溶液的pH,根据溶液酸碱性判断草酸酸性强弱;
II.(1)A.随水的增多,酸的电离程度在增大;
B.导电能力越强,离子浓度越大,氢离子浓度越大,pH越小;
C.用湿润的pH试纸测量酸性的pH,溶液稀释;
D.a、b、c三点溶液浓度不同,但溶质的物质的量相同;
(2)随水的增多,草酸的电离程度在增大;
III.C2O42-沉淀完全时,令CO32- 的浓度为a mol/L,由碳酸钙溶度积计算溶液中c(Ca 2+ ),进而表示出溶液中C2O42-的浓度的变化量,平衡时C2O42-的浓度,由草酸钙溶度积列方程计算.
解答 解:(1)H2C2O4是二元弱酸,在溶液中部分电离,分两步电离,其电离方程式为:H2C2O4?H++HC2O4-、HC2O4-?H++C2O42-;
故答案为:H2C2O4?H++HC2O4-、HC2O4-?H++C2O42-;
(2)草酸的酸性强于碳酸,草酸与NaHCO3反应生成草酸钠和二氧化碳、水,则该反应的离子方程式为2HCO3-+H2C2O4=C2O42-+2H2O+2CO2↑;
故答案为:2HCO3-+H2C2O4=C2O42-+2H2O+2CO2↑;
(3)二者恰好反应生成NaHC2O4,混合溶液呈酸性,则c(H+)>c(OH-),Na+不水解、HC2O4-水解,则c(Na+)>c(HC2O4-),溶液呈酸性说明HC2O4-电离程度大于水解程度,所以溶液中c(H+)>c(C2O42-),溶液呈酸性则c(OH-)浓度最小,则溶液中离子浓度大小顺序是c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-),
故答案为:c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-);
(4)A.测定0.1molL-1草酸溶液的pH,如果溶液中氢离子浓度小于草酸浓度的2倍,就说明草酸部分电离为弱电解质,故A正确;
B.将草酸溶液加入Na2CO3溶液中,有CO2放出,说明草酸酸性大于碳酸,但不能说明草酸部分电离,则不能证明草酸是弱酸,故B错误;
C.将草酸晶体溶于含酚酞的NaOH溶液中,溶液褪色,说明草酸具有酸性,但不能说明草酸部分电离,所以不能证明草酸是弱酸,故C错误;
D.测定草酸钠溶液的pH,如果草酸钠是强酸强碱盐,溶液呈中性,如果草酸钠是弱酸强碱盐,溶液呈碱性,所以能证明草酸是否是弱电解质,故D正确;
故选:AD;
II.(1)A.随水的增多,草酸的电离程度在增大,所以a、b、c三点草酸的电离程度:a<b<c,故A正确;
B.导电能力越强,离子浓度越大,氢离子浓度越大,pH越小,则a、b、c三点溶液的pH为b<a<c,故B错误;
C.用湿润的pH试纸测量酸性的pH,a处溶液溶液稀释,导电能力增大,pH减小,所以测量结果偏小,故C错误;
D.a、b、c三点溶液浓度不同,但溶质的物质的量相同,所以a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:a=b=c,故D错误;
故答案为:A;
(2)随水的增多,草酸的电离程度在增大,C2O42-物质的量增大,氢离子的物质的量增大,氢离子浓度先增大后减小,pH先减小,后增大,溶液中的c(H+)•c(OH-)是常数,不随浓度的改变而改变,故BD正确;
故答案为:BD;
III.C2O42-沉淀完全时,令CO32- 的浓度为a mol/L,由碳酸钙溶度积可知,溶液中c(Ca 2+ )=$\frac{5×1{0}^{-9}}{a}$mol/L,故C2O42-的浓度的变化量=(a-$\frac{5×1{0}^{-9}}{a}$)mol/L,平衡时C2O42-的浓度=0.6mol/L-(a-$\frac{5×1{0}^{-9}}{a}$)mol/L,由草酸钙溶度积可知:[0.6-(a-$\frac{5×1{0}^{-9}}{a}$)]×$\frac{5×1{0}^{-9}}{a}$=2.5×10-9,溶液中碳酸根浓度远大于钙离子浓度,可以近似为(0.6-a)×$\frac{5×1{0}^{-9}}{a}$=2.5×10-9,解得a=0.4,
故答案为:0.4mol/L.
点评 本题考查了弱电解质的电离、盐的水解、难溶物的溶解平衡等知识点,注意把握弱电解质电离电离平衡的影响因素,明确酸性越强的酸其酸根离子水解程度越小,再结合溶度积常数进行计算,难度中等.

(1)3Cl2+8NH3═6NH4Cl+N2
(2)Cu+4HNO3═Cu(NO3)2+2NO2↑+2H2O
(3)3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O
(4)KClO3+6HCl═KCl+3Cl2↑+3H2O( )
| A. | (1)、(4) | B. | 只有(3) | C. | 只有(2) | D. | (1)(2)(3)(4) |
| A. | 在熔融态能导电的物质一定是电解质 | |
| B. | 能溶于水且水溶液能导电的化合物是电解质 | |
| C. | 易溶性强电解质的水溶液中只有离子没有分子 | |
| D. | 饱和水溶液导电能力弱的电解质未必是弱电解质 |
| A. | 凡是放热反应都是自发的,凡是吸热反应都是非自发的 | |
| B. | 自发反应是无需外界条件就能自发进行的化学反应 | |
| C. | 在通常情况下,冰能自行融化,所以它是自发反应 | |
| D. | 由反应CaCO3(s)=CaO(s)+CO2(g)的特点分析可知其在高温下才能自发进行 |
(1)甲醇分子是极性分子(填“极性”或“非极性”).
(2)工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=-86.6KJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2,反应达到平衡时,容器内的压强是开始时的3/5.
①达到平衡时,CO的转化率为60%
②下列选项能判断该反应达到平衡状态的依据的有CE
A.2v(H2)=v(CH3OH) B.CO的消耗速率等于CH3OH的生成速率
C.容器内的压强保持不变 D.混合气体的密度保持不变
E.混合气体的平均相对分子质量不随时间而变化
(3)已知在常温常压下:
①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(g)△H=-akJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H=-bkl•mol-1
③H2O(g)=H2O(1)△H=-ckJ•mol-1
则CH3OH(1)+O2(g)═CO(g)+2H2O(1)△H=$\frac{1}{2}$(b-a-4c)kJ•mol-1
(4)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电.
①该电池负极的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O.
②若以该电池为电源,用石墨做电极电解200mL含有如下离子的溶液.
| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/mol•L-1 | 0.5 | 2 | 2 | 0.5 |
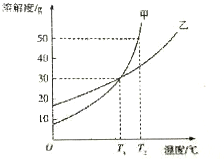 甲、乙两物质的溶解度曲线细图所示,假设溶液的密度为pg•cm-3,溶质的摩尔质量为Mg•mol-1,溶质的物质的量浓度为cmol•L-1,则下列叙述正确的是( )
甲、乙两物质的溶解度曲线细图所示,假设溶液的密度为pg•cm-3,溶质的摩尔质量为Mg•mol-1,溶质的物质的量浓度为cmol•L-1,则下列叙述正确的是( )| A. | T1℃时,甲、乙饱和溶液的物质的量浓度一定相等 | |
| B. | T1℃和T2℃时,甲的饱和溶液的质量分数之比为9:13 | |
| C. | T1℃时,在100g水中加入60g乙,则c(乙)=$\frac{1000×ρ(乙)×37.5%}{M(乙)}$ | |
| D. | T1℃和T2℃时,甲的饱和溶液的物质的量浓度之比为9:13 |
| A. | 10.0g C2H6 | B. | 标准状况下5.6L 空气 | ||
| C. | 1.0mol/L溶液中HCl | D. | 3.01×1023 个臭氧分子 |