题目内容
17.下列说法正确的是( )| A. | 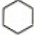 属于饱和烃 属于饱和烃 | |
| B. | 化合物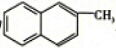 是苯的同系物 是苯的同系物 | |
| C. | 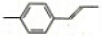 分子中碳原子一定共平面 分子中碳原子一定共平面 | |
| D. | 除甲酸外的羧酸均不能使酸性高锰酸钾溶液褪色 |
分析 A.仅有由碳氢单键和碳碳单键构成的烃是饱和烃;
B.结构相似,在分子组成上相差一个或n个-CH2原子团的有机物是同系物;
C.两个甲基和剩余C原子不一定共平面;
D.草酸能被酸性高锰酸钾溶液氧化.
解答 解:A.仅有由碳氢单键和碳碳单键构成的烃是饱和烃,环己烷中只有碳碳单键和碳氢键,所以属于饱和烃,故A正确;
B.结构相似,在分子组成上相差一个或n个-CH2原子团的有机物是同系物,该化合物中含有两个苯环,与苯不是同系物,故B错误;
C.根据甲烷结构知,两个甲基和剩余C原子不一定共平面,故C错误;
D.草酸能被酸性高锰酸钾溶液氧化,所以除甲酸外的羧酸不一定不能被酸性高锰酸钾溶液氧化,故D错误;
故选A.
点评 本题考查有机物结构和性质、基本概念等知识点,侧重考查学生分析判断及空间想象能力,明确基本概念内涵、常见物质结构、物质性质即可解答,易错选项是CD.

练习册系列答案
 特高级教师点拨系列答案
特高级教师点拨系列答案
相关题目
9.下列有关电解质的说法正确的是( )
| A. | 在熔融态能导电的物质一定是电解质 | |
| B. | 能溶于水且水溶液能导电的化合物是电解质 | |
| C. | 易溶性强电解质的水溶液中只有离子没有分子 | |
| D. | 饱和水溶液导电能力弱的电解质未必是弱电解质 |
10.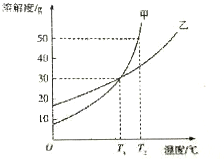 甲、乙两物质的溶解度曲线细图所示,假设溶液的密度为pg•cm-3,溶质的摩尔质量为Mg•mol-1,溶质的物质的量浓度为cmol•L-1,则下列叙述正确的是( )
甲、乙两物质的溶解度曲线细图所示,假设溶液的密度为pg•cm-3,溶质的摩尔质量为Mg•mol-1,溶质的物质的量浓度为cmol•L-1,则下列叙述正确的是( )
 甲、乙两物质的溶解度曲线细图所示,假设溶液的密度为pg•cm-3,溶质的摩尔质量为Mg•mol-1,溶质的物质的量浓度为cmol•L-1,则下列叙述正确的是( )
甲、乙两物质的溶解度曲线细图所示,假设溶液的密度为pg•cm-3,溶质的摩尔质量为Mg•mol-1,溶质的物质的量浓度为cmol•L-1,则下列叙述正确的是( )| A. | T1℃时,甲、乙饱和溶液的物质的量浓度一定相等 | |
| B. | T1℃和T2℃时,甲的饱和溶液的质量分数之比为9:13 | |
| C. | T1℃时,在100g水中加入60g乙,则c(乙)=$\frac{1000×ρ(乙)×37.5%}{M(乙)}$ | |
| D. | T1℃和T2℃时,甲的饱和溶液的物质的量浓度之比为9:13 |
5.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度T的关系如表所示:
回答下列问题:
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)×c({H}_{2}O)}{c(C{O}_{2})×c({H}_{2})}$.
(2)该反应为吸热反应(填“吸热”或“放热”).
(3)能判断该反应达到化学平衡状态的依据是BC.
A.容器中压强不变 B.混合气体中C(CO)不变
C.v(H2)正=v(H2O)逆 D.C(CO)=C(H2)
E.混合气体的密度保持不变 F.混合气体的平均相对分子质量保持不变
(4)某温度下,平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O),试判断此时的温度为830℃.
(5)在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为C(CO2)为2mol/L,C(H2)为 1.5mol/L,C(CO) 为1mol/L,C(H2O)为 3mol/L,则下一时刻,反应向逆向移动(填“正向”,“逆向”或“不”),依据:浓度商Qc=$\frac{1×3}{2×1.5}$=1>800℃时平衡常数K=0.9.
| T/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)×c({H}_{2}O)}{c(C{O}_{2})×c({H}_{2})}$.
(2)该反应为吸热反应(填“吸热”或“放热”).
(3)能判断该反应达到化学平衡状态的依据是BC.
A.容器中压强不变 B.混合气体中C(CO)不变
C.v(H2)正=v(H2O)逆 D.C(CO)=C(H2)
E.混合气体的密度保持不变 F.混合气体的平均相对分子质量保持不变
(4)某温度下,平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O),试判断此时的温度为830℃.
(5)在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为C(CO2)为2mol/L,C(H2)为 1.5mol/L,C(CO) 为1mol/L,C(H2O)为 3mol/L,则下一时刻,反应向逆向移动(填“正向”,“逆向”或“不”),依据:浓度商Qc=$\frac{1×3}{2×1.5}$=1>800℃时平衡常数K=0.9.
2.氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2+6C+2N2$\frac{\underline{\;高温\;}}{\;}$Si3N4+6CO.下列对该反应的说法正确的是( )
| A. | 该反应的氧化剂是SiO2和N2 | |
| B. | 该反应的还原产物为CO | |
| C. | 该反应中氧化剂和还原剂质量比为9:7 | |
| D. | 生成1mol Si3N4时共转移12mol电子 |
9.下列气体所含分子数最多的是( )
| A. | 10.0g C2H6 | B. | 标准状况下5.6L 空气 | ||
| C. | 1.0mol/L溶液中HCl | D. | 3.01×1023 个臭氧分子 |
6.碳酸锰主要用于制备软磁铁氧体,工业上以软锰矿(主要成分MnO2)和黄铁矿
(主要成分FeS2)为主要原料制备碳酸锰(MnCO3难溶,分解温度较高)的一种工艺流程如下:
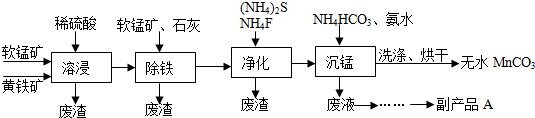
已知:几种金属离子沉淀的pH如下表:
回答下列问题:
(1)为了提高溶浸工序中原料的浸出效率,可以采取的措施有ABC
A.适当升高温度 B.搅拌 C.研磨矿石 D.加入足量的蒸馏水
(2)溶浸过程中发生的主要反应如下,请完成并配平该反应的离子方程式:
2FeS2+15MnO2+28H+=2Fe3++15Mn2++4SO42ˉ+14H2O
(3)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质.
请写出除去Cu2+的离子方程式:Cu2++S2ˉ=CuS↓;
若测得滤液中c(Fˉ)=0.01mol•Lˉ1,则滤液中残留c(Ca2+)=1.5×10-6mol•Lˉ1.
[已知:Ksp(CaF2)=1.5×10ˉ10]
(4)除铁工序中,先加入适量的软锰矿,其作用是使残余Fe2+转化为Fe3+,再加入石灰调节溶液的pH的范围为3.7~5.2.
(5)副产品A的主要成分是(NH4)2SO4.
(主要成分FeS2)为主要原料制备碳酸锰(MnCO3难溶,分解温度较高)的一种工艺流程如下:

已知:几种金属离子沉淀的pH如下表:
| Fe2+ | Fe3+ | Cu2+ | Mn2+ | |
| 开始沉淀的pH | 7.5 | 3.2 | 5.2 | 8.8 |
| 完全沉淀的pH | 9.7 | 3.7 | 7.8 | 10.4 |
(1)为了提高溶浸工序中原料的浸出效率,可以采取的措施有ABC
A.适当升高温度 B.搅拌 C.研磨矿石 D.加入足量的蒸馏水
(2)溶浸过程中发生的主要反应如下,请完成并配平该反应的离子方程式:
2FeS2+15MnO2+28H+=2Fe3++15Mn2++4SO42ˉ+14H2O
(3)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质.
请写出除去Cu2+的离子方程式:Cu2++S2ˉ=CuS↓;
若测得滤液中c(Fˉ)=0.01mol•Lˉ1,则滤液中残留c(Ca2+)=1.5×10-6mol•Lˉ1.
[已知:Ksp(CaF2)=1.5×10ˉ10]
(4)除铁工序中,先加入适量的软锰矿,其作用是使残余Fe2+转化为Fe3+,再加入石灰调节溶液的pH的范围为3.7~5.2.
(5)副产品A的主要成分是(NH4)2SO4.
 ;
;