题目内容
2. CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标.
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标.(1)250℃时,以镍合金为催化剂,向4L容器中通入6mol CO2、6mol CH4,发生如下反应:
CO2(g)+CH4(g)?2CO(g)+2H2(g).平衡体系中各组分体积分数如下表:
| 物质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
②已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.3kJ•mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g)△H=-41.2kJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1
反应CO2(g)+CH4(g)?2CO(g)+2H2(g) 的△H=+247.3kJ•mol-1
(2)以二氧化钛表面覆盖Cu2Al2O4(难溶于水)为催化剂,可以将CO2和CH4直接氧化成乙酸.
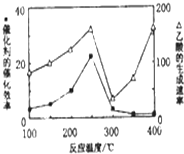
①不同温度下催化剂的催化效率与乙酸的生成速率如图所示.250~300℃时,温度升高而乙酸的生成速率降低的原因温度超过250℃时,催化剂的催化效率降低.
②为了提高该反应中CH4的转化率,可以采取的措施是增大反应压强或增大CO2的浓度等.(答一条即可)
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为3 Cu2Al2O4+32 H++2 NO3-=6 Cu2++6 Al3++2 NO↑+16 H2O.
分析 (1)向4L容器中通入6mol CO2、6mol CH4,设平衡时转化的二氧化碳为xmol,则:
CO2(g)+CH4(g)?2CO(g)+2H2(g)
起始量(mol):6 6 0 0
变化量(mol):x x 2x 2x
平衡量(mol):6-x 6-x 2x 2x
平衡时二氧化碳、CO的体积分数分别为0.1、0.4,则2x=4×(6-x),解得x=4,
①根据v=$\frac{△c}{△t}$计算v(CO2);平衡常数K=$\frac{{c}^{2}(CO)×{c}^{2}({H}_{2})}{c(C{O}_{2})×c(C{H}_{4})}$;
②已知:Ⅰ.CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.3kJ•mol-1
Ⅱ.CO(g)+H2O (g)=CO2(g)+H2 (g)△H=-41.2kJ•mol-1
Ⅲ.2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1
根据盖斯定律,Ⅰ+Ⅱ×2-Ⅲ×2可得:CO2(g)+CH4(g)?2CO(g)+2H2(g),焓变也进行相应计算;
(2)发生反应:CO2(g)+CH4(g)$\stackrel{催化剂}{→}$CH3COOH(g),
①催化剂活性受温度影响,温度超过250℃时,催化剂的催化效率降低;
②为了提高该反应中CH4的转化率,可以增大压强或增大二氧化碳浓度、将生成乙酸移走等;
③将Cu2Al2O4中Cu为+1甲,溶解在稀硝酸中生成硝酸铜、硝酸铝、NO与水.
解答 解:(1)向4L容器中通入6mol CO2、6mol CH4,设平衡时转化的二氧化碳为xmol,则:
CO2(g)+CH4(g)?2CO(g)+2H2(g)
起始量(mol):6 6 0 0
变化量(mol):x x 2x 2x
平衡量(mol):6-x 6-x 2x 2x
平衡时二氧化碳、CO的体积分数分别为0.1、0.4,则2x=4×(6-x),解得x=4,
①v(CO2)=$\frac{\frac{4mol}{4L}}{tmin}$=$\frac{1}{t}$mol/(L.min);平衡常数K=$\frac{{c}^{2}(CO)×{c}^{2}({H}_{2})}{c(C{O}_{2})×c(C{H}_{4})}$=$\frac{(\frac{8}{4})^{2}×(\frac{8}{4})^{2}}{\frac{2}{4}×\frac{2}{4}}$=64,
故答案为:$\frac{1}{t}$mol/(L.min);64;
②已知:Ⅰ.CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.3kJ•mol-1
Ⅱ.CO(g)+H2O (g)=CO2(g)+H2 (g)△H=-41.2kJ•mol-1
Ⅲ.2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1
根据盖斯定律,Ⅰ+Ⅱ×2-Ⅲ×2可得:CO2(g)+CH4(g)?2CO(g)+2H2(g),则△H=-802.3kJ•mol-1+2×(-41.2kJ•mol-1)-2×(-566.0kJ•mol-1)=+247.3 kJ•mol-1,
故答案为+247.3;
(2)发生反应:CO2(g)+CH4(g)$\stackrel{催化剂}{→}$CH3COOH(g),
①催化剂活性受温度影响,温度超过250℃时,催化剂的催化效率降低,乙酸的生成速率降低,
故答案为:温度超过250℃时,催化剂的催化效率降低;
②为了提高该反应中CH4的转化率,可以增大压强或增大二氧化碳浓度、将生成乙酸移走等,
故答案为:增大反应压强或增大CO2的浓度等;
③将Cu2Al2O4中Cu为+1甲,溶解在稀硝酸中生成硝酸铜、硝酸铝、NO与水,反应离子方程式为:3 Cu2Al2O4+32 H++2 NO3-=6 Cu2++6 Al3++2 NO↑+16 H2O,
故答案为:3 Cu2Al2O4+32 H++2 NO3-=6 Cu2++6 Al3++2 NO↑+16 H2O.
点评 本题考查化学平衡计算、反应热计算、反应速率影响条件、化学方程式书写等,侧重考查学生对知识的迁移应用,难度中等.

 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案| A. | 它们是同种元素 | B. | 它们的化学性质不同 | ||
| C. | 它们是同位素关系 | D. | 它们是同种原子 |
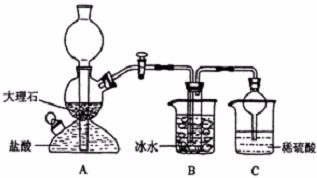
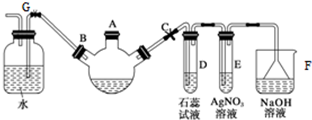
(1)A装置中所发生反应的离子方程式为:CaCO3+2H+=Ca2++CO2+H2O.C装置中稀硫酸的作用为:吸收从B装置中的试管内逸出的氨气,减少对环境的污染.
(2)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100g水)
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
(3)该校学生在检查完此套装置气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在A与B装置之间(填写字母)连接一个盛有饱和NaHCO3溶液 的洗气装置,其作用是除去CO2中混合的HCl气体.
(4)若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.04g,则NaHCO3的产率为60%.
| A. | HClO的结构式:H-O-Cl | |
| B. | 质子数为92、中子数为146的U原子:${\;}_{92}^{146}$U | |
| C. | CH2F2的电子式: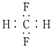 | |
| D. | Cl-的结构示意图: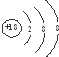 |
| A. | 强电解质在溶液中完全电离,其水溶液中不存在分子 | |
| B. | 同一弱电解质溶液,温度不同时,导电能力不同 | |
| C. | 强电解质溶液导电能力不一定比弱电解质溶液的导电能力强 | |
| D. | 强电解质在液态时不一定会导电,但在固态时一定不导电 |
 .
.