题目内容
6.被称为红帘石的铁矿含锰量高,锰是冶炼锰钢的重要原料.红帘石主要成分有磁铁矿(Fe3O4)、菱铁矿(FeCO3)、锰矿(MnO2和MnCO3)、石棉[Mg3Si3O7(OH)4]等.工业上将红帘石处理后,运用阴离子膜电解法的新技术提取金属锰并制得高效水处理剂(K2FeO4).工业流程如下: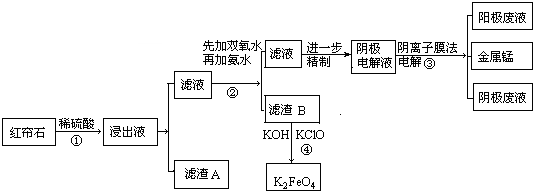
(1)工业上为提高稀硫酸浸取效率一般采取的措施是(任意写两种方法)
①粉碎红帘石②提高反应的温度.
(2)浸出液中的阳离子有H+、Fe2+、Fe3+、Mg2+、Mn2+.(填离子符号)
(3)滤渣A中无MnO2原因MnO2在酸性条件下被二价铁还原为Mn2+.
(4)已知不同金属离子生成氢氧化物沉淀所需的pH如下表:
| 离子 | Fe3+ | Fe2+ | Mn2+ | Mg2+ |
| 开始沉淀的pH | 2.7 | 7.0 | 7.8 | 9.3 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.8 | 10.8 |
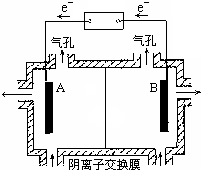
过程②中加氨水调节溶液的pH等于6,则滤渣B的成分Fe(OH)3.
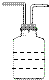
(5)电解装置如图所示,则溶液中阴离子移动的方向为A→B(填“A→B”或“B→A”).实际生产中,阳极以稀硫酸为电解液,阳极的电极反应式为2H2O-4e-=O2↑+4H+.
(6)滤渣B经反应④生成高效水处理剂的离子方程式2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O.K2FeO4被誉为高效水处理剂的原因是FeO42-具有强氧化性可以杀菌消毒,还原成Fe3+水解成Fe(OH)3胶体能吸附杂质生成沉淀.
分析 红帘石主要成分有磁铁矿(Fe3O4)、菱铁矿(FeCO3)、锰矿(MnO2和MnCO3)、石棉[Mg3Si3O7(OH)4]等和稀硫酸反应,MnO2在酸性条件下被二价铁还原为Mn2+,浸出液中的离子有:Fe2+、Fe3+、Mg2+、Mn2+、SO42-,滤渣A为SiO2,滤液中加入双氧水,双氧水氧化亚铁离子生成铁离子,再加入氨水生成氢氧化铁沉淀,滤渣B为氢氧化铁,加入氢氧化钾、次氯酸钾反应2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O生成K2FeO4,滤液为Mg2+、Mn2+、SO42-,电解生成金属锰.
(1)增大接触面积、提高温度可以提高反应速率,所以粉碎红帘石、提高反应的温度可以提高稀硫酸浸取效率;
(2)红帘石主要成分和稀硫酸反应,MnO2在酸性条件下被二价铁还原为Mn2+,浸出液中的离子有:Fe2+、Fe3+、Mg2+、Mn2+、SO42-;
(3)二氧化锰中+4价的锰具有氧化性,亚铁离子具有还原性,两者发生氧化还原反应;
(4)过程②中加氨水调节溶液的pH等于6,完全沉淀时其pH<6的氢氧化物都能完全沉淀;
(5)电解阳极失去电子发生氧化反应,阴极得到电子发生还原反应,阳极以稀硫酸为电解液,阳极水电离出的氢氧根离子失去电子;
(6)次氯酸根离子具有氧化性,在碱性条件下氧化+3铁生成+6价铁,K2FeO4被誉为高效水处理剂的原因+6价铁具有氧化性能杀菌,生成的+3价铁水解生成氢氧化铁胶体吸附悬浮物净水.
解答 解:(1)增大接触面积可提高反应的速率,温度越高,反应速率越快,所以工业上为提高稀硫酸浸取效率一般采取的措施有:提高反应温度、采用粉碎红帘石可增大接触面积等,
故答案为:①粉碎红帘石;②提高反应的温度;
(2)红帘石主要成分有磁铁矿(Fe3O4)、菱铁矿(FeCO3)、锰矿(MnO2和MnCO3)、石棉[Mg3Si3O7(OH)4]等,加入硫酸:Fe3O4+4H2SO4=FeSO4+Fe2(SO4)3+4H2O、FeCO3+H2SO4=FeSO4+CO2↑+H2O,MnCO3+H2SO4=MnSO4+CO2↑+H2O,2Fe2++MnO2+4H+═2Fe3++Mn2++2H2O,滤渣A为SiO2,浸出液中的阳离子有H+、Fe2+、Fe3+、Mg2+、Mn2+,
故答案为:H+、Fe2+、Fe3+、Mg2+、Mn2+;
(3)滤渣A中无MnO2原因MnO2在酸性条件下被二价铁还原为Mn2+,反应为:2Fe2++MnO2+4H+═2Fe3++Mn2++2H2O,
故答案为:MnO2在酸性条件下被二价铁还原为Mn2+;
(4)过程②中加氨水调节溶液的pH等于6,完全沉淀时其pH<6的氢氧化物都能完全沉淀,根据表中数据知,Fe(OH)3,完全沉淀时需要的pH=3.7<6,所以滤渣的成分是Fe(OH)3,
故答案为:Fe(OH)3;
(5)图示电解时原电池电子流向为A→B,则A为原电池的负极,A连接的电极为电解池的阴极,电解时阴离子移向阳极,则溶液中阴离子移动的方向为A→B,实际生产中,阳极以稀硫酸为电解液,阳极发生氧化反应,反应为:2H2O-4e-=O2↑+4H+,
故答案为:A→B;2H2O-4e-=O2↑+4H+;
(6)次氯酸根离子具有氧化性,在碱性条件下氧化+3铁,反应为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O,K2FeO4被誉为高效水处理剂的原因+6价铁具有氧化性能杀菌,生成的+3价铁水解Fe3+可水解水解的方程式为Fe3++3H2O?Fe(OH)3(胶体)+3H+,生成具有吸附性的Fe(OH)3胶体,吸附杂质生成沉淀,
故答案为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;FeO42-具有强氧化性可以杀菌消毒,还原成Fe3+水解成Fe(OH)3胶体能吸附杂质生成沉淀.
点评 本题考查了提取金属锰并制得高效水处理剂(K2FeO4)工艺流程,侧重考查物质分离和提纯方法的综合应用,要从整体上分析各个步骤发生的反应、反应原理等知识点,题目难度中等.

| A. | 加水稀释,溶液中所有离子的浓度都减小 | |
| B. | 溶液中n(CH3COO-)+n(CH3COOH)=0.1mol | |
| C. | 升高温度,醋酸的电离度增大 | |
| D. | 中和1L等物质的量浓度的NaOH溶液所消耗的醋酸体积大于1L |
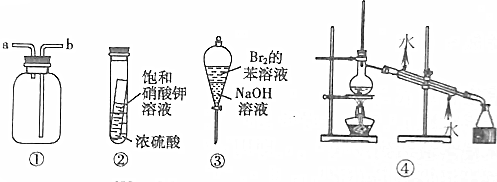
| A. | 装置①可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体 | |
| B. | 实验②放置一段时间后,小试管内有晶体析出 | |
| C. | 实验③振荡后静置,上层溶液颜色变浅 | |
| D. | 实验④可用于分离饱和Na2CO3溶液和CH3COOC2H5 |
 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法:2Cu+H2O $\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑ |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
(2)方法Ⅰ制备过程会产生有毒气体,每生成1g该有毒气体,能量变化a kJ,写出制备反应的热化学方程式2CuO(s)+C(s)=Cu2O(s)+CO(g)△H=+28akJ•mol-1.
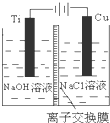
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极生成Cu2O反应式为2Cu-2e-+2OH-=Cu2O+H2O.
(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2.该制法的化学方程式为4Cu(OH)2+N2H4$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2O+N2↑+6H2O.
(5)方法Ⅲ可以用甲醛稀溶液替代肼,但因反应温度较高而使部分产品颗粒过大,过滤(填操作名称)可分离出颗粒过大的Cu2O.
(6)在相同的密闭容器中,用方法Ⅱ和方法Ⅲ制得的Cu2O分别进行催化分解水的实验:2H2O(g)$\frac{\underline{\;光照\;}}{Cu_{2}O}$2H2(g)+O2(g)△H>0水蒸气的浓度(mol•L-1)随时间t(min)变化如下表:
| 序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
②取等量①的滤液于两支试管中,分别滴加等浓度等体积的Na2S溶液、Na2SO4溶液,前者出现浑浊,后者溶液仍澄清.
③取少量①的沉淀,滴加几滴氨水,沉淀逐渐溶解.
下列分析不正确的是( )
| A. | ①中生成AgCl沉淀,溶液中c(Ag+)和c(Cl-)大量减少 | |
| B. | ①的滤液中不含有Ag+ | |
| C. | ②的现象说明该温度下Ag2S比Ag2SO4更难溶 | |
| D. | ③中生成Ag(NH3)2+,使c(Ag+)减小,促进AgCl(s)溶解平衡正向移动 |