题目内容
18.用石墨作电极电解500mLH2SO4和CuSO4的混合溶液,通电一段时间后,两极均收集到11.2L气体(标准状况),原混合溶液中Cu2+的物质的量浓度为1 mol/L.分析 用惰性电极电解H2SO4与CuSO4的混合溶液时,阳极上始终是氢氧根离子放电,阴极上首先是铜离子反应,再是氢离子放电,两极得失电子守恒,据此分析.
解答 解:用惰性电极电解H2SO4与CuSO4的混合溶液时,阳极上始终是氢氧根离子放电,电极反应式为4OH--4e-=O2↑+2H2O,生成1.12L氧气,即$\frac{11.2L}{22.4L/mol}$=0.5mol,共失电子0.5mol×4=2mol;
阴极首先是铜离子放电,电极反应式为Cu2++2e-=Cu,铜离子反应完成后,再时氢离子放电,电极反应式为2H++2e-=H2↑,生成11.2L氢气,即0.5mol,得电子0.5mol×2=1mol,据得失电子守恒,铜离子得电子1mol,则有铜离子0.5mol,所以铜离子的物质的量浓度为:$\frac{0.5mol}{0.5L}$=1mol/L,故答案为:1.
点评 本题考查了电解池的工作原理以及电极反应式的书写知识,注意电解过程中的电子守恒是关键,题目难度中等.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
16.下列推断中,符合实际的是( )
| A. | 第n周期的最后一种金属元素位于第n主族(n>1) | |
| B. | 第n周期有(8-n)种非金属元素(n>1) | |
| C. | 若元素原子最外层电子数为m,电子层为n,则m-n=5的主族元素最高价含氧酸为最强酸 | |
| D. | 短周期元素中最外层电子数为2的元素一定是第ⅡA族元素 |
17.W、X、Y、Z均为短周期元素,W、X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-具有相同的电子层结构,W和Z的最外层电子数相同.下列说法正确的是( )
| A. | W、X的最高价氧化物对应水化物的酸性:X>W | |
| B. | 单质沸点:Y>Z>W | |
| C. | 离子半径:X->W->Y+>Z- | |
| D. | 结合质子能力:X2->W- |
6.被称为红帘石的铁矿含锰量高,锰是冶炼锰钢的重要原料.红帘石主要成分有磁铁矿(Fe3O4)、菱铁矿(FeCO3)、锰矿(MnO2和MnCO3)、石棉[Mg3Si3O7(OH)4]等.工业上将红帘石处理后,运用阴离子膜电解法的新技术提取金属锰并制得高效水处理剂(K2FeO4).工业流程如下:
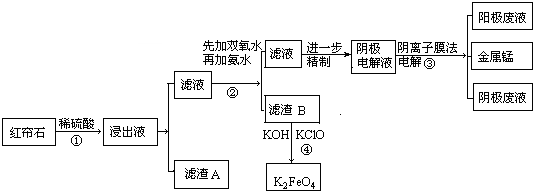
(1)工业上为提高稀硫酸浸取效率一般采取的措施是(任意写两种方法)
①粉碎红帘石②提高反应的温度.
(2)浸出液中的阳离子有H+、Fe2+、Fe3+、Mg2+、Mn2+.(填离子符号)
(3)滤渣A中无MnO2原因MnO2在酸性条件下被二价铁还原为Mn2+.
(4)已知不同金属离子生成氢氧化物沉淀所需的pH如下表:
过程②中加氨水调节溶液的pH等于6,则滤渣B的成分Fe(OH)3.
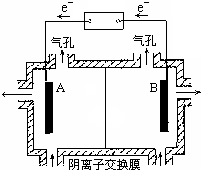
(5)电解装置如图所示,则溶液中阴离子移动的方向为A→B(填“A→B”或“B→A”).实际生产中,阳极以稀硫酸为电解液,阳极的电极反应式为2H2O-4e-=O2↑+4H+.
(6)滤渣B经反应④生成高效水处理剂的离子方程式2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O.K2FeO4被誉为高效水处理剂的原因是FeO42-具有强氧化性可以杀菌消毒,还原成Fe3+水解成Fe(OH)3胶体能吸附杂质生成沉淀.

(1)工业上为提高稀硫酸浸取效率一般采取的措施是(任意写两种方法)
①粉碎红帘石②提高反应的温度.
(2)浸出液中的阳离子有H+、Fe2+、Fe3+、Mg2+、Mn2+.(填离子符号)
(3)滤渣A中无MnO2原因MnO2在酸性条件下被二价铁还原为Mn2+.
(4)已知不同金属离子生成氢氧化物沉淀所需的pH如下表:
| 离子 | Fe3+ | Fe2+ | Mn2+ | Mg2+ |
| 开始沉淀的pH | 2.7 | 7.0 | 7.8 | 9.3 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.8 | 10.8 |

过程②中加氨水调节溶液的pH等于6,则滤渣B的成分Fe(OH)3.
(5)电解装置如图所示,则溶液中阴离子移动的方向为A→B(填“A→B”或“B→A”).实际生产中,阳极以稀硫酸为电解液,阳极的电极反应式为2H2O-4e-=O2↑+4H+.
(6)滤渣B经反应④生成高效水处理剂的离子方程式2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O.K2FeO4被誉为高效水处理剂的原因是FeO42-具有强氧化性可以杀菌消毒,还原成Fe3+水解成Fe(OH)3胶体能吸附杂质生成沉淀.
13.某兴趣小组同学在实验室用加热1-丁醇、浓H2SO4和溴化钠混合物的方法来制备1-溴丁烷,并检验反应的部分副产物,设计了如图所示装置,其中夹持仪器、加热仪器及冷却水管没有画出.

请根据实验步骤,回答下列问题:
(1)关闭a和b、接通竖直冷凝管的冷凝水,给A加热30分钟,制备1-溴丁烷.竖直冷凝管接通冷凝水,进水口是Ⅱ(填“I”或“Ⅱ”);冷凝回流的主要目的是充分反应,提高反应物的转化率.
(2)理论上,上述反应的副产物可能有:丁醚(CH3CH2CH2CH2-O-CH2CH2CH2CH3)、1-丁烯、溴化氢、硫酸氢钠、水等.熄灭酒精灯,在竖直冷凝管上方塞上塞子并打开a,利用余热继续反应直至冷却,通过B、C装置检验部分副产物.B、C中应盛放的试剂分别是石蕊试液(或AgNO3溶液)和溴水(或酸性KMnO4溶液),写出C装置中主要的化学方程式:CH3CH2CH=CH2+Br2→BrCH2CHBrCH2CH3 .
(3)为了进一步分离提纯1-溴丁烷,该兴趣小组同学查得相关有机物的数据如表所示:
请你补充下列实验步骤,直到分离出1-溴丁烷.
①待烧瓶冷却后,拔去竖直的冷凝管;
②插上带橡皮塞的温度计;
③关闭a,打开b;
④接通冷凝管的冷凝水,使冷水从d处流入;
⑤迅速升高温度至101.6℃,收集所得馏分.
(4)若实验中所取1-丁醇、NaBr分别为7.4g、13.0g,蒸出的粗产物经洗涤、干燥后再次蒸馏得到9.6g 1-溴丁烷,则1-溴丁烷的产率是70%.(保留2位有效数字)

请根据实验步骤,回答下列问题:
(1)关闭a和b、接通竖直冷凝管的冷凝水,给A加热30分钟,制备1-溴丁烷.竖直冷凝管接通冷凝水,进水口是Ⅱ(填“I”或“Ⅱ”);冷凝回流的主要目的是充分反应,提高反应物的转化率.
(2)理论上,上述反应的副产物可能有:丁醚(CH3CH2CH2CH2-O-CH2CH2CH2CH3)、1-丁烯、溴化氢、硫酸氢钠、水等.熄灭酒精灯,在竖直冷凝管上方塞上塞子并打开a,利用余热继续反应直至冷却,通过B、C装置检验部分副产物.B、C中应盛放的试剂分别是石蕊试液(或AgNO3溶液)和溴水(或酸性KMnO4溶液),写出C装置中主要的化学方程式:CH3CH2CH=CH2+Br2→BrCH2CHBrCH2CH3 .
(3)为了进一步分离提纯1-溴丁烷,该兴趣小组同学查得相关有机物的数据如表所示:
| 物质 | 熔点/℃ | 沸点/℃ |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
①待烧瓶冷却后,拔去竖直的冷凝管;
②插上带橡皮塞的温度计;
③关闭a,打开b;
④接通冷凝管的冷凝水,使冷水从d处流入;
⑤迅速升高温度至101.6℃,收集所得馏分.
(4)若实验中所取1-丁醇、NaBr分别为7.4g、13.0g,蒸出的粗产物经洗涤、干燥后再次蒸馏得到9.6g 1-溴丁烷,则1-溴丁烷的产率是70%.(保留2位有效数字)
7.现有常温下pH=2的盐酸甲和pH=2的醋酸溶液乙,请根据下列操作回答问题:
(1)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是A
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ C.c(H+)•c(OH-) D.$\frac{c(O{H}^{-})}{c({H}^{+})}$
(2)取10mL的乙溶液,加入等体积的水,醋酸的电离平衡向右(填“向左”、“向右”或“不”)移动;另取10mL的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$的比值将减小(填“增大”、“减小”或“无法确定”).
(3)相同条件下,取等体积的甲、乙两溶液,各稀释100倍.稀释后的溶液,其pH大小关系为:pH(甲)>pH(乙)(填“>”、“<”或“=”).
(4)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液完全中和,则消耗的NaOH溶液的体积大小关系为:V(甲)<V(乙)(填“>”、“<”或“=”).
(5)已知25℃时,两种酸的电离平衡常数如下:
下列四种离子结合H+能力最强的是B.
A.HCO${\;}_{3}^{-}$ B.CO${\;}_{3}^{2-}$ C.ClO- D.CH3COO-
写出下列反应的离子方程式:
CH3COOH+NaCO2(少量):2CH3COOH+CO32-=H2O+CO2↑+2CH3COO-;
HClO+Na2CO3(少量):HClO+CO32-=ClO-+HCO3-.
(1)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是A
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ C.c(H+)•c(OH-) D.$\frac{c(O{H}^{-})}{c({H}^{+})}$
(2)取10mL的乙溶液,加入等体积的水,醋酸的电离平衡向右(填“向左”、“向右”或“不”)移动;另取10mL的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$的比值将减小(填“增大”、“减小”或“无法确定”).
(3)相同条件下,取等体积的甲、乙两溶液,各稀释100倍.稀释后的溶液,其pH大小关系为:pH(甲)>pH(乙)(填“>”、“<”或“=”).
(4)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液完全中和,则消耗的NaOH溶液的体积大小关系为:V(甲)<V(乙)(填“>”、“<”或“=”).
(5)已知25℃时,两种酸的电离平衡常数如下:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数K1 | 1.8×10-5 | 4.3×10-7 | 3×10-8 |
| K2 | -- | 5.6×10-11 | -- |
A.HCO${\;}_{3}^{-}$ B.CO${\;}_{3}^{2-}$ C.ClO- D.CH3COO-
写出下列反应的离子方程式:
CH3COOH+NaCO2(少量):2CH3COOH+CO32-=H2O+CO2↑+2CH3COO-;
HClO+Na2CO3(少量):HClO+CO32-=ClO-+HCO3-.
8.近几年流行喝苹果醋.苹果酸(α-羟基丁二酸)是这种饮料的主要酸性物质,苹果酸的结构式为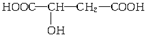 ,下列说法不正确的是( )
,下列说法不正确的是( )
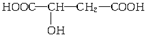 ,下列说法不正确的是( )
,下列说法不正确的是( )| A. | 苹果酸在一定条件下能发生酯化反应 | |
| B. | 苹果酸在一定条件下能发生催化氧化反应 | |
| C. | 苹果酸在一定条件下能发生加成反应 | |
| D. | 苹果酸在一定条件下能发生缩聚反应 |