题目内容
14.下列物质中,属于共价化合物的是( )| A. | NH4Cl | B. | SO2 | C. | Cl2 | D. | Na2SO4 |
分析 含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,只含共价键的化合物是共价化合物,共价化合物中只含共价键,一定不含离子键.
解答 解:A.氯化铵中铵根离子和氯离子之间存在离子键、N-H原子之间存在共价键,属于离子化合物,故A错误;
B.二氧化硫分子中只含共价键,为共价化合物,故B正确;
C.氯气分子中只含共价键,但氯气是单质不是化合物,故C错误;
D.硫酸钠中钠离子和硫酸根离子之间存在离子键、硫酸根离子中S-O原子之间存在共价键,属于离子化合物,故D错误;
故选B.
点评 本题考查离子化合物和共价化合物的判断,侧重考查基本概念,明确物质的构成微粒及微粒之间作用力即可判断,明确化学键和化合物类型关系,易错选项是A,注意不能根据是否含有金属元素判断离子键,为易错点.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案
相关题目
4.下列有关物质结构的说法正确的是( )
| A. | 78gNa2O2晶体中所含阴、阳离子个数均为2NA | |
| B. | HBr的电子式为H+(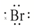 )- )- | |
| C. | 3.4g氨气中含有0.6NA个N-H键 | |
| D. | PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构 |
5.某温度下,某反应达到平衡,平衡常数k=C(CO2).C(H2)/C(CO).C(H2O).恒容时,升高温度,CO浓度增大.下列说法正确的是( )
| A. | 升高温度,逆反应速率增大,正反应速率减小 | |
| B. | 恒温时,增大压强,CO浓度不变 | |
| C. | 该反应的化学方程式为:CO2+H2?CO+H2O | |
| D. | 该反应的焓变为负值 |
2.下列含有非极性键的共价化合物是( )
| A. | H2 | B. | Na2O2 | C. | H2O2 | D. | CH4 |
19.下列离子在溶液中可以大量共存的一组是( )
| A. | NH4+ Na+ OH- | B. | Na+ H+ SO32- | ||
| C. | K+ NO3- Cl- | D. | Ca2+ NO3- CO32- |
3.电解降解法可用于治理水体硝酸盐污染,将NO3-降解成N2的电解装置如图所示.下列说法正确的是( 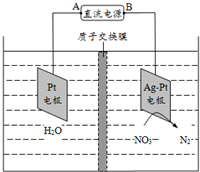

| A. | 电源的正极为b | |
| B. | 电解时H+从膜右侧迁移到膜左侧 | |
| C. | Ag-Pt电极反应为:2H2O-4e-=4H++O2↑ | |
| D. | 若转移的电子数为1.204×1024,生成N25.6 g |
16.含硫48%的硫铁矿煅烧时FeS2损失率为2%,则下列说法不正确的是( )
| A. | 该硫铁矿含FeS2也是48% | B. | 硫损失也是2% | ||
| C. | 铁损失也是2% | D. | 该硫铁矿含铁42% |
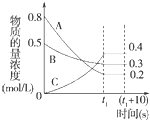 在一定条件下,A气体与B气体反应生成C气体.反应过程中,反应物与生成物的浓度随时间变化的曲线如图.回答下列问题:
在一定条件下,A气体与B气体反应生成C气体.反应过程中,反应物与生成物的浓度随时间变化的曲线如图.回答下列问题: 2C.
2C.