题目内容
16.含硫48%的硫铁矿煅烧时FeS2损失率为2%,则下列说法不正确的是( )| A. | 该硫铁矿含FeS2也是48% | B. | 硫损失也是2% | ||
| C. | 铁损失也是2% | D. | 该硫铁矿含铁42% |
分析 A.令矿石为100g,则S的质量为48g,根据m(FeS2)=$\frac{120}{64}$×m(S)计算;
B.根据S元素守恒计算;
C.根据Fe元素守恒计算;
D.令矿石为100g,则S的质量为48g,根据m(Fe)=$\frac{56}{64}$×m(S)计算Fe的质量,再计算Fe的质量分数.
解答 解:A.令矿石为100g,则S的质量为48g,m(FeS2)=$\frac{120}{64}$×m(S)=$\frac{120}{64}$×48g=90g,则FeS2的含量为$\frac{90g}{100g}$×100%=90%,故A错误;
B.硫48%的硫铁矿煅烧时FeS2损失率为2%,由S元素守恒可知,S损失2%,故B正确;
C.硫48%的硫铁矿煅烧时FeS2损失率为2%,由Fe元素守恒可知,Fe损失2%,故C正确;
D.令矿石为100g,则S的质量为48g,m(Fe)=$\frac{56}{64}$×m(S)=$\frac{56}{64}$×48g=42g,则Fe的质量分数为$\frac{42g}{100g}$×100%=42%,故D正确;
故选A.
点评 本题考查了物质含量的计算,题目难度不大,注意根据元素守恒计算,侧重于考查学生的计算能力.

练习册系列答案
相关题目
14.下列物质中,属于共价化合物的是( )
| A. | NH4Cl | B. | SO2 | C. | Cl2 | D. | Na2SO4 |
7.对于某一已经建立平衡的可逆反应,当条件改变或采取某项措施时使平衡向正反应方向移动,以下叙述中正确的是( )
①生成物的质量分数一定增大
②生成物的产量一定增加
③反应物的转化率一定增大
④反应物的浓度一定降低
⑤正反应速率一定大于逆反应速率
⑥一定使用催化剂.
①生成物的质量分数一定增大
②生成物的产量一定增加
③反应物的转化率一定增大
④反应物的浓度一定降低
⑤正反应速率一定大于逆反应速率
⑥一定使用催化剂.
| A. | ①②③ | B. | ②④⑤ | C. | ③④⑤ | D. | ②⑤ |
8.下列有关钠的叙述中,错误的是( )
| A. | 钠的还原性很强,可以用来冶炼金属钛、锆、铌等 | |
| B. | 电解熔融氯化钠时,钠离子被还原为钠 | |
| C. | 钠是一种灰黑色的固体 | |
| D. | 钠的质地软,熔点低于100℃ |
5.标准状况下,将NO2和O2按4:1体积比充满一烧瓶,烧瓶倒置于水中待液面稳定(假设溶质不向外扩散),则烧瓶内溶液的物质的量浓度为(mol/L)( )
| A. | 1 | B. | 0.8 | C. | $\frac{1}{22.4}$ | D. | $\frac{1}{28}$ |
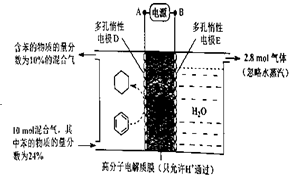
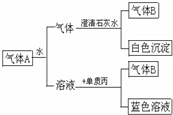 如图所示将红热固体单质甲,投入显黄色的溶液乙中,剧烈反应产生混合气体A,A在常温下不与空气反应,根据下列变化填空:
如图所示将红热固体单质甲,投入显黄色的溶液乙中,剧烈反应产生混合气体A,A在常温下不与空气反应,根据下列变化填空:
 .
.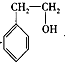 +CH3COOH$?_{△}^{浓硫酸}$
+CH3COOH$?_{△}^{浓硫酸}$ +H2O.
+H2O. 、、
、、 、
、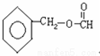 .
.