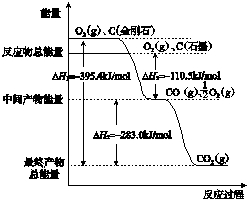
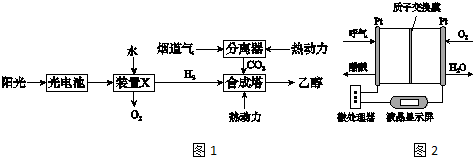
题目内容
6.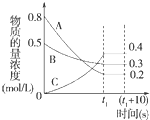 在一定条件下,A气体与B气体反应生成C气体.反应过程中,反应物与生成物的浓度随时间变化的曲线如图.回答下列问题:
在一定条件下,A气体与B气体反应生成C气体.反应过程中,反应物与生成物的浓度随时间变化的曲线如图.回答下列问题:(1)该反应的化学方程式为3A+B
 2C.
2C.(2)0~t1 s内A气体的反应速率为$\frac{0.6}{{t}_{1}}$mol•L-1•min-1.
(3)反应后与反应前的压强之比为$\frac{13}{9}$.
(4)(t1+10)s时,A气体的体积分数为$\frac{2}{9}$,此时v(A)正=v(B)逆(填“>”、“<”或“=”).
(5)关于该反应的说法正确的是bc.
a.到达t1时刻该反应已停止
b.在t1时刻之前B气体的消耗速率大于它的生成速率
c.在t1时刻C气体的正反应速率等于逆反应速率
d.在t1时刻达到平衡是因为此时反应物总物质的量与生成物总物质的量相等.
分析 (1)根据图象中A、B、C浓度的变化趋势判断反应物和生成物,根据浓度变化之比等于化学剂量数之比确定反应的化学方程式;
(2)根据v=$\frac{△c}{△t}$计算反应速率;
(3)根据总浓度与平衡时总浓度之比等于压强之比计算;
(4)(t1+10)s时,各物质的浓度不变,平衡没有移动;
(5)a.到达t1时刻达到平衡状态;
b.在t1时刻之前反应正向进行;
c.在t1时刻达到平衡状态;
d.在t1时刻达到平衡时正逆反应速率相同.
解答 解:(1)由图象可知,在反应中,A的浓度逐渐减小,B、C的浓度逐渐增大,则A、B为反应物,C为生成物,相同时间内浓度的变化比值为c(A):c(B):c(C)=(0.8-0.2):(0.5-0.3):0.4=3:1:2,化学反应中浓度变化之比等于化学剂量数之比,则化学方程式为3A+B 2C,
2C,
故答案为:3A+B 2C;
2C;
(2)反应从开始进行至时间t1,用气体A浓度变化表示的该反应的反应速率为:v=$\frac{△c}{△t}$=$\frac{0.8mol/L-0.2mol/L}{{t}_{1}}$=$\frac{0.6}{{t}_{1}}$mol•L-1•min-1,
故答案为:$\frac{0.6}{{t}_{1}}$mol•L-1•min-1;
(3)反应前总的浓度为0.8+0.5=1.3mol/L,平衡时总浓度为0.2+0.3+0.4=0.9mol/L,则反应后与反应前的压强之比为$\frac{1.3}{0.9}$=$\frac{13}{9}$,
故答案为:$\frac{13}{9}$.
(4)(t1+10)s时,各物质的浓度不变,A气体的体积分数为$\frac{0.2}{0.2+0.3+0.4}$=$\frac{2}{9}$,平衡没有移动,所以v(A)正=v(B)逆;
故答案为:$\frac{2}{9}$;=;
(5)a.到达t1时刻达到平衡状态,正逆反应速率相同,但是速率不为零,故a错误;
b.在t1时刻之前反应正向进行,则B气体的消耗速率大于它的生成速率,故b正确;
c.在t1时刻达到平衡状态,C气体的正反应速率等于逆反应速率,故c正确;
d.在t1时刻达到平衡时正逆反应速率相同,各物质的浓度保持不变,故d错误.
故答案为:bc.
点评 本题考查了根据图象写方程式、化学反应速率的计算及化学平衡移动,难度中等,解题关键是准确分析图表.

| A. | 卤代烃都可发生取代反应 | |
| B. | 由2-氯丙烷制取少量的1,2-丙二醇时,只需要经过取代反应、水解反应 | |
| C. | 实验室制硝基苯时,正确的操作顺序应该是先加入苯,再滴加浓硫酸,最后滴加浓硝酸 | |
| D. | 2-甲基-2-丁烯可以形成顺反异构 |
| A. | NH4Cl | B. | SO2 | C. | Cl2 | D. | Na2SO4 |
| A. | 4.6 g NO2与N2O4的混合物中含有的N原子数为0.1NA | |
| B. | 常温常压下,22.4 L NO的分子数为0.1NA | |
| C. | 将0.3mol NO2溶于水,完全反应后,转移的电子数为0.2 NA | |
| D. | 1L0.1mol•L-1 氨水中含有的NH3分子数为0.1NA |
| A. | 苯酚、乙醇、苯、四氯化碳 | B. | 乙烯、乙烷、乙炔、丙烯 | ||
| C. | 甲酸、乙醛、甲酸钠溶液、乙酸乙酯 | D. | 苯乙烯、苯酚、乙苯、甲苯 |
①生成物的质量分数一定增大
②生成物的产量一定增加
③反应物的转化率一定增大
④反应物的浓度一定降低
⑤正反应速率一定大于逆反应速率
⑥一定使用催化剂.
| A. | ①②③ | B. | ②④⑤ | C. | ③④⑤ | D. | ②⑤ |
| A. | 钠的还原性很强,可以用来冶炼金属钛、锆、铌等 | |
| B. | 电解熔融氯化钠时,钠离子被还原为钠 | |
| C. | 钠是一种灰黑色的固体 | |
| D. | 钠的质地软,熔点低于100℃ |