题目内容
【题目】过氧化镁(MgO2)易溶于稀酸,溶于酸后会产生过氧化氢,在医学上可作为“解酸剂”等。过氧化镁产品中常会混有一定量的MgO,实验室可通过多种方案测定样品中过氧化镁的含量。某研究小组拟用如图装置测定一定质量的样品中过氧化镁的含量。
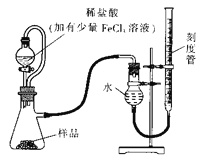
【1】实验前需进行的操作是: _______,稀盐酸中加入少量FeCl3溶液的作用是:_________。
【2】用恒压分液漏斗的优点有:
① ___________;
② 使分液漏斗内液体顺利滴下。
实验结束时,待恢复至室温,先_______,再平视刻度线读数。
实验室还可通过下列两种方案来测定样品中过氧化镁的含量:
方案I:取a g样品,加入足量稀盐酸,充分反应后再加入 NaOH溶液至Mg2+沉淀完全,过滤、洗涤后,将滤渣充分灼烧,最终得到b g固体。
【3】推算该样品中过氧化镁的质量分数_______ (用含a、b的表达式表示)。
方案Ⅱ:称取0.1 g样品置于某定量用锥形瓶中,加入15 mL0.6 mol/LKI溶液和足量盐酸,摇匀后在暗处静置5 min,然后用0.1 mol/L Na2S2O3溶液滴定,滴定到终点时共消耗28.5 mL Na2S2O3溶液。(已知:I2+2Na2S2O3→Na2S4O6+2NaI)
【4】该实验在滴定前需加入少量______作指示剂;判断到达滴定终点的现象是_____;推算该样品中过氧化镁的质量分数为____(保留三位小数)。
【答案】
【1】 检查装置的气密性 用作催化剂(或催化H2O2的分解)
【2】 消除滴入溶液的体积对所测气体体积的影响 将右侧刻度管缓缓向下移动直到两侧液面相平
【3】![]()
【4】 淀粉溶液 蓝色变无色且半分钟内不变色 0.798
【解析】
1.实验前,需要检查装置是否有漏气现象,过氧化镁与稀盐酸反应生成双氧水,双氧水发生分解需要催化剂。
2.用恒压分液漏斗的优点有:
①确保气体的体积不受影响;
② 使分液漏斗内液体顺利滴下。
实验结束时,待恢复至室温,先消除压力差,再平视刻度线读数。
3.a g为MgO2和MgO的质量,b g为MgO的质量,可列方程或利用差量法求出样品中MgO2的质量,从而推算该样品中过氧化镁的质量分数。
4.该实验在滴定前需加入少量淀粉作指示剂;滴定终点时发生颜色改变;推算该样品中过氧化镁的质量分数时,可利用反应建立关系式MgO2——H2O2——I2——2Na2S2O3,然后代入数据进行计算。
【1】为防装置内气体外逸,实验前需进行的操作是:检查装置的气密性,稀盐酸中加入少量FeCl3溶液的作用是:用作催化剂(或催化H2O2的分解)。答案为:检查装置的气密性;用作催化剂(或催化H2O2的分解);
【2】恒压分液漏斗与一般分液漏斗相比,多了一根连通管,可让装置内气体进入漏斗内,避免负压的形成,其优点有:
①消除滴入溶液的体积对所测气体体积的影响;
② 使分液漏斗内液体顺利滴下。
实验结束时,待恢复至室温,为防止产生压力差,影响气体体积的测量,应先将右侧刻度管缓缓向下移动直到两侧液面相平,再平视刻度线读数。答案为:消除滴入溶液的体积对所测气体体积的影响;将右侧刻度管缓缓向下移动直到两侧液面相平;
【3】a g为MgO2和MgO的质量,b g为MgO的质量,n(MgO2)=![]() mol,从而推算该样品中过氧化镁的质量分数为
mol,从而推算该样品中过氧化镁的质量分数为 =
=![]() 。答案为:
。答案为:![]() ;
;
【4】该实验在滴定前需加入少量淀粉溶液作指示剂;判断到达滴定终点的现象是蓝色变无色且半分钟内不变色;在滴定过程中,发生反应的关系式为:
MgO2——H2O2——I2——2Na2S2O3,n(MgO2)=![]() n(Na2S2O3)=
n(Na2S2O3)=![]() ×0.1 mol/L×28.5 ×10-3L=1.425×10-3mol,该样品中过氧化镁的质量分数为
×0.1 mol/L×28.5 ×10-3L=1.425×10-3mol,该样品中过氧化镁的质量分数为![]() =0.798。答案:淀粉溶液;蓝色变无色且半分钟内不变色;0.798。
=0.798。答案:淀粉溶液;蓝色变无色且半分钟内不变色;0.798。
在确定指示剂的颜色变化时,我们常会把现象弄反,可先确定滴定前的颜色。碘水中滴加淀粉,变蓝色,由此可确定颜色变化为蓝变无。

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案【题目】下列我国科技成果所涉及物质的应用中,发生的不是化学变化的是
|
|
|
|
A.甲醇低温所制氢气用于新能源汽车 | B.氘、氚用作“人造太阳”核聚变燃料 | C.偏二甲肼用作发射“天宫二号”的火箭燃料 | D.开采可燃冰,将其作为能源使用 |
A. A B. B C. C D. D
【题目】用以下图示装置研究物质的性质,能够获得可靠结论的是
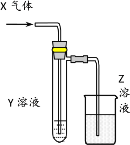
X | Y | Z | 结论 | |
A | HCHO | 新制Cu(OH)2 | NaOH(aq) | 验证甲醛的还原性 |
B | CH3Cl | AgNO3(aq) | NaOH(aq) | 验证一氯甲烷含氯元素 |
C | SO2 | KMnO4(aq) | NaOH(aq) | 验证二氧化硫的漂白性 |
D | Cl2 | 淀粉KI(aq) | NaOH(aq) | 验证氯气的强氧化性 |
A.AB.BC.CD.D