题目内容
【题目】某小型化工厂生产皓矾(ZnSO4·7H2O)的工艺流程如下图所示:
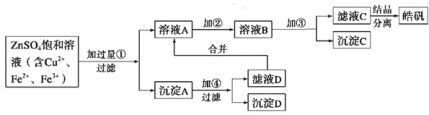
已知:开始生成氢氧化物沉淀到沉淀完全的pH范围分别为Fe(OH)3:2.7~3.7;Fe(OH)2:7.6~9.6;Zn(OH)2:5.7~8.0。
试回答下列问题:
(1)加入的试剂①应是________,其目的是____________________________________。
(2)加入的试剂②,供选择使用的有:氨水、NaClO溶液、20% H2O2溶液、浓硫酸、浓硝酸等,应选用________,其理由是_____________________。
(3)加入的试剂③是________,目的是______________________________________。
【答案】Zn 将Cu2+、Fe3+、Fe2+等杂质离子除去 20% H2O2溶液 H2O2作氧化剂,可将Fe2+氧化为Fe3+,且不引入其他杂质 ZnO或Zn(OH)2(答案合理即可) 调节溶液的pH,使Fe3+转化为Fe(OH)3沉淀
【解析】
此小型化工厂的生产目的,是制取皓矾(ZnSO4·7H2O),所以流程的主线是有关ZnSO4的除杂与净化。溶液A中肯定含有大量ZnSO4,则滤液D中含有ZnSO4,沉淀A必然是金属单质。
(1)由以上分析,可确定加入的试剂①应是能将Cu2+、Fe2+、Fe3+转化为金属单质的某金属,从而去除杂质。
(2)选择试剂②时,应从能将Fe2+氧化为Fe3+,且不引入新的杂质离子的角度考虑。
(3)加入的试剂③是能将Fe3+全部转化为Fe(OH)3沉淀,且不引入新的杂质的物质。
(1)由以上分析,可确定加入的试剂①应是金属活动性比Fe、Cu强的Zn,能将Cu2+、Fe2+、Fe3+转化为金属单质,且过量时可再利用。答案为:Zn;将Cu2+、Fe3+、Fe2+等杂质离子除去;
(2)试剂②,能将Fe2+氧化为Fe3+,所以该物质应具有较强的氧化性,可选择NaClO溶液、20% H2O2溶液、浓硫酸、浓硝酸等,但NaClO溶液、浓硫酸、浓硝酸都会引入新的杂质,所以只能选择20% H2O2溶液。答案为:20% H2O2溶液;
(3)加入的试剂③,能将Fe3+全部转化为Fe(OH)3沉淀,即具有消耗H+、促进Fe3+水解的能力,且不引入新的杂质,由此确定该物质为锌的氧化物、氢氧化物、碳酸盐等,但不能是金属锌(会将Fe3+还原)。答案为:ZnO或Zn(OH)2(答案合理即可);调节溶液的pH,使Fe3+转化为Fe(OH)3沉淀。