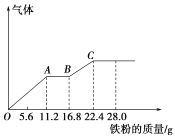
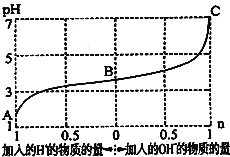
题目内容
【题目】用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液时,下列实验操作会引起测量结果偏高的是
①用天平称量NaOH固体,将小烧杯放在右盘,砝码放在左盘,并移动游码,使之平衡;②在配制烧碱溶液时,将称量后的NaOH固体溶于水,立即移入容量瓶,将洗涤烧杯的液体注入容量瓶后,加蒸馏水至刻度线;③中和滴定时,锥形瓶内有少量水;④酸式滴定管用蒸馏水洗后,未用标准液润洗;⑤读取滴定管终点读数时,仰视刻度线。
A.①②③B.③④⑤C.②④⑤D.①②③④⑤
【答案】C
【解析】
①使用天平时左码右物测量值比实际值偏小,配成溶液浓度偏低,造成V(标准)偏小,根据c(碱)= ,可知c(碱)偏小,故①错误;
,可知c(碱)偏小,故①错误;
②NaOH固体溶于水后立即移入容量瓶,NaOH溶解是放热反应,溶液体积膨胀,立刻加蒸馏水至刻度线,待溶液冷却后,溶液体积减小,则可知配得溶液浓度偏高,进而滴定结果偏高,故②正确;
③NaOH溶液进入锥形瓶后,决定滴定结果的只有NaOH的物质的量,锥形瓶中的蒸馏水对结果无影响,故③错误;
④用蒸馏水洗净酸滴定管后盛入标准盐酸,则盐酸被稀释,造成V(酸)偏大,根据c(碱)= ,可知c(碱)偏大,故④正确;
,可知c(碱)偏大,故④正确;
⑤仰视刻度线则读数偏大,造成V(酸)偏大,根据c(碱)= ,可知c(碱)偏大,故⑤正确;
,可知c(碱)偏大,故⑤正确;
答案选C。

 全优测试卷系列答案
全优测试卷系列答案 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案【题目】根据下列实验操作和现象所得的结论正确的是( )
选项 | 实验操作和现象 | 结论 |
A | 相同条件下,分别测量0.1molL-1和0.01molL-1的醋酸溶液的导电性,前者的导电性强 | 醋酸浓度越大,电离程度越大 |
B | 将Fe(NO3)2溶于稀H2SO4后,滴加KSCN溶液,溶液变成红色 | 原Fe(NO3)2中一定含有Fe3+ |
C | 向AgCl悬浊液中滴入KI溶液,悬浊液变为黄色 | Ksp(AgCl)>Ksp(AgI) |
D | 常温下,分别测量浓度均为0.1molL-1的Na2S溶液和NaClO溶液的pH,前者的pH大 | 酸性:HClO>H2S |
A.AB.BC.CD.D
【题目】已知锌矿渣中含有ZnSO4、FeS2、SiO2、FeSO4、CuSO4 等,利用锌矿渣生产硫酸锌和氧化铁流程如下:
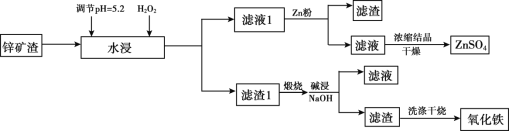
4FeS2+11O2  2Fe2O3+8SO2
2Fe2O3+8SO2
已知:i.FeS2不溶于水和稀酸。
ii.金属离子氢氧化物开始沉淀和沉淀完全时的pH
氢氧化物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
开始沉淀时的pH | 6.5 | 7.5 | 2.2 |
沉淀完全时的pH | 8.5 | 9.5 | 3.5 |
iii.SiO2难溶于水,可溶于强碱生成一种可溶性盐。
(1)加入H2O2的目的是________。
(2)检验滤液1中不含Fe3+的方法是________,滤液1加入锌粉的作用是_____________(用离子方程式表示)。
(3)滤渣1的成分主要有 _________(写化学式),加入NaOH碱浸时反应的离子方程式是__________。
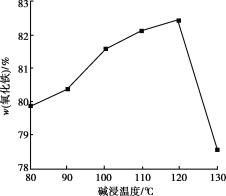
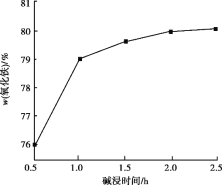
(4)用NaOH进行碱浸时,氧化铁含量与碱浸温度、碱浸时间关系如图所示,碱浸的最佳温度和时间为__________。
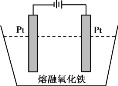
(5)传统钢铁冶炼高耗能、高污染,科学家寻找绿色环保的钢铁冶炼技术,通过电解的方法将铁矿石中的氧化铁(熔融态)变成金属铁。电解的示意图如图所示,请在图中标出两极名称及离子运动方向___________,并写出阴极电极反应式_______。