题目内容
4.已知CO的燃烧热为△H=-283kJ/mol;氢气的燃烧热为△H=-286kJ/mol;CH4的燃烧热为△H=-890kJ/mol.(1)若 1molCH4气体完全燃烧生成CO2气体和水蒸气,放出热量为<890kJ( 填“>”、“<”、“=”).
(2)若将a molCH4、CO和H2的混合气体完全燃烧,生成CO2气体和液态水时,则放出热量(Q)的取值范围是283nKJ<Q<890nKJ.
分析 (1)根据燃烧热的概念以及不同聚集状态的水的能量不同,以及能量高低进行判断;
(2)根据燃烧热利用极限法计算.
解答 解:(1)CH4的燃烧热为△H=-890kJ/mol,即1molCH4气体完全燃烧生成CO2气体和液态水放出890KJ热量,水由气态变为液态时要放热,则1mol CH4气体完全燃烧生成CO2气体和水蒸气,放出热量小于890kJ;
故答案为:<;
(2)若气体全部是CH4,则nmolCH4完全燃烧放出热量为890nKJ;同理,nmolCO完全燃烧放出热量为283nKJ;
nmolH2完全燃烧放出热量为286nKJ;故将将nmolCH4、CO和H2的混合气体完全燃烧生成气体和液态水,放出热量Q的取值范围是:283nKJ<Q<890nKJ.
故答案为:283nKJ<Q<890nKJ.
点评 本题主要考查反应热的计算,注意能够根据物质的状态判断对反应热的影响以及极限法的计算运用,难度不大.

练习册系列答案
相关题目
9.用下列方法来制备胶体,能够得到胶体的是( )
| A. | 将等体积、等物质的量浓度的BaCl2溶液和硫酸相混合并振荡 | |
| B. | 把1 mL饱和三氯化铁溶液逐滴加入到20 mL温水中,边加边振荡,并加热到沸腾 | |
| C. | 把1 mL饱和三氯化铁溶液一次性加入到20 mL沸水中,并加以搅拌 | |
| D. | 把1 mL饱和三氯化铁溶液逐滴加入到20 mL沸水中,边加边振荡 |
15.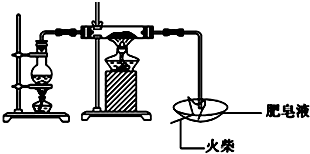 某研究小组为了探究“铁与水蒸气”的反应的产物,进行了下列实验:用如图所示实验装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”(石棉绒高温下不与水和铁反应).
某研究小组为了探究“铁与水蒸气”的反应的产物,进行了下列实验:用如图所示实验装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”(石棉绒高温下不与水和铁反应).
(1)如何检查该装置的气密性:将C处导气管末端浸入水槽中,加热A处圆底烧瓶,导管末端出现气泡,停止加热后导管末端出现一段水柱
(2)写出铁与水蒸气反应的化学方程式3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$ Fe3O4+4H2
(3)验证固体产物中铁元素的价态
限选实验仪器与试剂:烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹;1mol/L CuSO4、3mol/L H2SO4、3mol/L HNO3、30%H2O2、0.01mol/L KMnO4、20%KSCN、蒸馏水.
在答题卡上按下表的格式写出实验步骤、预期现象与结论.
步骤1中加入足量1mol/L CuSO4溶液的作用是除去反应后固体中可能未反应完的铁粉,以免影响后续实验的结果分析.
 某研究小组为了探究“铁与水蒸气”的反应的产物,进行了下列实验:用如图所示实验装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”(石棉绒高温下不与水和铁反应).
某研究小组为了探究“铁与水蒸气”的反应的产物,进行了下列实验:用如图所示实验装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”(石棉绒高温下不与水和铁反应).(1)如何检查该装置的气密性:将C处导气管末端浸入水槽中,加热A处圆底烧瓶,导管末端出现气泡,停止加热后导管末端出现一段水柱
(2)写出铁与水蒸气反应的化学方程式3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$ Fe3O4+4H2
(3)验证固体产物中铁元素的价态
限选实验仪器与试剂:烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹;1mol/L CuSO4、3mol/L H2SO4、3mol/L HNO3、30%H2O2、0.01mol/L KMnO4、20%KSCN、蒸馏水.
在答题卡上按下表的格式写出实验步骤、预期现象与结论.
| 实验步骤 | 预期现象与结论 | |
| 步骤1 | 取反应后干燥的固体ag于试管中,加入足量的1mol/L CuSO4溶液,充分振荡,经固液分离、洗涤后,再向固体中滴加足量的3mol/L H2SO4,振荡溶解,过滤后将滤液配成250mL溶液,待用. | |
| 步骤2 | 取少量步骤1中滤液于试管中,滴加1~2滴20%KSCN | 溶液变红色,则固体产物含+3价铁 |
| 步骤3 | 取少量步骤1中滤液于试管中,滴加1~2滴0.01mol/L KMnO4 | 溶液紫色褪去,则固体产物含+2价铁 |
19.下列物质肯定为纯净物的是( )
| A. | 汽油 | B. | C2H4 | C. | 煤焦油 | D. | 聚氯乙烯 |
9.CO、H2在一定条件下的密闭容器中合成乙醇:2CO+4H2?CH3CH2OH+H2O,下列说法错误的是( )
| A. | 向该容器中增加CO的量可加大反应速率 | |
| B. | 增大H2的用量,有可能使CO转化率达到100% | |
| C. | 使用合适的催化剂、升高温度均可加大反应速率 | |
| D. | 在一定条件下,当CO的浓度不再改变时,反应达到最大限度 |
16.下列说法不正确的是( )
| A. | 明矾、漂白粉都可以用于净水,但净水原理不相同 | |
| B. | 游离态氮转化为化合态氮,只有在高温、高压和催化剂的作用下才能实现 | |
| C. | 制造光缆和计算机芯片的主要材料都含有硅元素 | |
| D. | 农业上使用高效低毒的农药,可降低蔬菜的农药残留 |
13.化学是一门以实验为基础的学科,请完成下列有关实验问题.
Ⅰ.如图是实验室中制备气体或验证气体性质的装置图
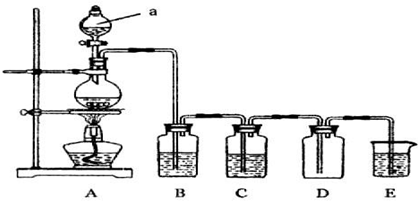
(1)写出用A制取氯气的化学方程式MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O.
(2)利用上图装置制备纯净的氯气,并证明氧化性:Cl2>Fe3+,则装置B中的溶液的作用是除去氯气中的氯化氢;装置D中加的最佳试剂是(填序号)c:
供选试剂:a.浓H2SO4 b.FeCl2溶液 c.KSCN与FeCl2的混合溶液 d.无水氯化钙
(3)在如图所示圆底烧瓶内加入碳,a中加入浓硫酸,开始实验,加热产生的气体缓慢通过后续装置同时完成如下实验:
实验1:证明SO2具有氧化性和漂白性
实验2:证明碳元素的非金属性比硅元素的强
此时,B中为少量Na2S溶液、C中加品红溶液,D中应加入足量的酸性高锰酸钾(填溶液名称),E中加入Na2SiO3溶液(填化学式).
(4)证明碳元素的非金属性比硅元素的强的现象为D中高锰酸钾溶液不褪色,E中溶液变浑浊;
实验2不严谨之处应如何改进将烧杯换成洗气瓶,右端连接盛有碱石灰的干燥管.
Ⅱ、向烧碱和Na2SO3的混合溶液中加入少量溴水,振荡后溶液变为无色.反应后的溶液中含有大量的SO32-、SO42-、Br-、OH-等阴离子,请填写鉴定其中SO32-、SO42-和Br-的实验报告.
限选试剂:2mol/LHCl,1mol/L H2SO4,l mol/LBaCl2,l mol/LBa(NO3)2,0.1mol/LAgNO3,CCl4,新制饱和溴水,新制饱和氯水.
Ⅰ.如图是实验室中制备气体或验证气体性质的装置图

(1)写出用A制取氯气的化学方程式MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O.
(2)利用上图装置制备纯净的氯气,并证明氧化性:Cl2>Fe3+,则装置B中的溶液的作用是除去氯气中的氯化氢;装置D中加的最佳试剂是(填序号)c:
供选试剂:a.浓H2SO4 b.FeCl2溶液 c.KSCN与FeCl2的混合溶液 d.无水氯化钙
(3)在如图所示圆底烧瓶内加入碳,a中加入浓硫酸,开始实验,加热产生的气体缓慢通过后续装置同时完成如下实验:
实验1:证明SO2具有氧化性和漂白性
实验2:证明碳元素的非金属性比硅元素的强
此时,B中为少量Na2S溶液、C中加品红溶液,D中应加入足量的酸性高锰酸钾(填溶液名称),E中加入Na2SiO3溶液(填化学式).
(4)证明碳元素的非金属性比硅元素的强的现象为D中高锰酸钾溶液不褪色,E中溶液变浑浊;
实验2不严谨之处应如何改进将烧杯换成洗气瓶,右端连接盛有碱石灰的干燥管.
Ⅱ、向烧碱和Na2SO3的混合溶液中加入少量溴水,振荡后溶液变为无色.反应后的溶液中含有大量的SO32-、SO42-、Br-、OH-等阴离子,请填写鉴定其中SO32-、SO42-和Br-的实验报告.
限选试剂:2mol/LHCl,1mol/L H2SO4,l mol/LBaCl2,l mol/LBa(NO3)2,0.1mol/LAgNO3,CCl4,新制饱和溴水,新制饱和氯水.
| 编号 | 实验操作 | 预期现象和结论 |
| 步骤① | 在试管A中加入少量待测液,加入足量氯水,再加入四氯化碳,振荡,静置后观察颜色. | 溶液分层,下层呈橙红色,证明待测液中含Br-. |
| 步骤② | 在试管B中加入少量待测液,加入过量的2mol/L盐酸,再滴加1mol/L BaCl2溶液 | 有白色沉淀生成, 证明待测液中含SO42-. |
| 步骤③ | 在试管C中加入少量待测液,滴加2mol/LHCl至溶液呈酸性,加入几滴新制饱和溴水(填试剂),振荡. | 溴水褪色, 证明待测液中含SO32-. |
14.请选择合适的试剂除去括号内的杂质.
| 序号 | 被提纯物(杂质) | 试剂 |
| ① | CH3CH3( CH2=CH2) | |
| ② | CH2=CH2(SO2) | |
| ③ | 乙酸乙酯 (乙酸) | |
| ④ | 乙醇(水) |