题目内容
9.CO、H2在一定条件下的密闭容器中合成乙醇:2CO+4H2?CH3CH2OH+H2O,下列说法错误的是( )| A. | 向该容器中增加CO的量可加大反应速率 | |
| B. | 增大H2的用量,有可能使CO转化率达到100% | |
| C. | 使用合适的催化剂、升高温度均可加大反应速率 | |
| D. | 在一定条件下,当CO的浓度不再改变时,反应达到最大限度 |
分析 A.向该容器中增加CO的量可加大正逆反应速率;
B.可逆反应不能完全转化;
C.催化剂、升高温度能加快反应速率;
D.当CO的浓度不再改变时,说明正逆反应速率相等,达平衡状态.
解答 解:A.向该容器中增加CO的量,反应物转化为生成物,所以可加大正逆反应速率,故A正确;
B.可逆反应不能完全转化,所以增大H2浓度不能使CO转化率达到100%,故B错误;
C.选择合适的催化剂、升高温度都能加快反应速率,故C正确;
D.平当CO的浓度不再改变时,说明正逆反应速率相等,达平衡状态,也就是反应达到最大限度,故D正确;
故选B.
点评 本题考查化学平衡及化学反应速率,注意反应为可逆反应、放热反应来分析解答,题目难度不大.

练习册系列答案
相关题目
20.某学生做同主族元素性质递变规律的实验时,自己设计了一套实验方案,并记录了有关实验现象.现在请你帮助该学生整理并完成实验报告.
(1)实验目的:探究同一主族元素性质的递变规律
(2)实验用品:药品:氯水、溴水、溴化钠溶液、碘化钾溶液、四氯化碳.
仪器:①试管;②胶头滴管(请填写两件主要的玻璃仪器)
(3)实验内容:
(4)实验结论:同一主族元素,自上而下,元素的非金属性依次减弱.
(5)问题和讨论:请用结构理论简单说明得出上述结论的原因.同一主族元素,自上而下,元素原子的电子层数增多,原子半径增大,原子核对最外层电子的吸引力逐渐减弱.
(1)实验目的:探究同一主族元素性质的递变规律
(2)实验用品:药品:氯水、溴水、溴化钠溶液、碘化钾溶液、四氯化碳.
仪器:①试管;②胶头滴管(请填写两件主要的玻璃仪器)
(3)实验内容:
| 序号 | 实验方案 | 实验现象 |
| ① | 将少量氯水滴入盛有少量NaBr溶液的试管中,振荡;再滴入少量四氯化碳,振荡 | 加入氯水后,溶液由无色变为橙色,滴入四氯化碳后,水层颜色变浅,四氯化碳层(下层)变为橙红色 |
| ② | 将少量溴水滴入盛有少量KI溶液的试管中,振荡;再滴入少量四氯化碳,振荡 | 加入溴水后,溶液由无色变为黄色,滴入四氯化碳后,水层颜色变浅,四氯化碳层(下层)变为紫色 |
(5)问题和讨论:请用结构理论简单说明得出上述结论的原因.同一主族元素,自上而下,元素原子的电子层数增多,原子半径增大,原子核对最外层电子的吸引力逐渐减弱.
14.某课外小组对一些金属单质和化合物的性质进行研究.
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
按反应类型写出实验中发生反应的化学方程式各一个(是离子反应的只写离子方程式)
置换反应2Al+3Cu2+=2Al3++3Cu;化合反应2Cu+O2+CO2+H2O=Cu2(OH)2CO3.
(2)工业上可用铝与软锰矿(主要成分为MnO2)反应来冶炼金属锰.MnO2在H2O2分解反应中作催化剂.若将适量MnO2加入酸化后的H2O2溶液中,MnO2溶解产生Mn2+.该反应的离子方程式是MnO2+H2O2+2H+═Mn2++O2↑+2H2O.
(3)某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾.其设计的实验过程如图所示:

①铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于c上(用以下所给仪器的编号填入,下同),取用坩埚应使用e,灼烧后的坩埚应放在b上,不能直接放在桌面上.实验所用仪器:a.蒸发皿 b.石棉网 c.泥三角 d.表面皿 e.坩埚钳 f.试管夹
②由粗制氧化铜通过两种途径制取胆矾,通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、加热蒸发、冷却结晶、过滤洗涤、自然干燥,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是:产生等量胆矾途径Ⅱ消耗硫酸少、途径Ⅱ不会产生污染大气的气体.
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
| 实验步骤 | 实验现象 |
| 将打磨过的铝片(过量)放入一定浓度的氯化铜溶液中 | 产生气泡,析出疏松的红色固体,溶液逐渐变为无色 |
| 反应结束后分离出溶液备用 | |
| 红色固体用蒸馏水洗涤后,置于潮湿的空气中 | 一段时间后固体由红色变为绿色[视其主要成分为Cu2(OH)2CO3] |
置换反应2Al+3Cu2+=2Al3++3Cu;化合反应2Cu+O2+CO2+H2O=Cu2(OH)2CO3.
(2)工业上可用铝与软锰矿(主要成分为MnO2)反应来冶炼金属锰.MnO2在H2O2分解反应中作催化剂.若将适量MnO2加入酸化后的H2O2溶液中,MnO2溶解产生Mn2+.该反应的离子方程式是MnO2+H2O2+2H+═Mn2++O2↑+2H2O.
(3)某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾.其设计的实验过程如图所示:

①铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于c上(用以下所给仪器的编号填入,下同),取用坩埚应使用e,灼烧后的坩埚应放在b上,不能直接放在桌面上.实验所用仪器:a.蒸发皿 b.石棉网 c.泥三角 d.表面皿 e.坩埚钳 f.试管夹
②由粗制氧化铜通过两种途径制取胆矾,通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、加热蒸发、冷却结晶、过滤洗涤、自然干燥,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是:产生等量胆矾途径Ⅱ消耗硫酸少、途径Ⅱ不会产生污染大气的气体.
1.科学家通过如下反应O2+PtF6═O2PtF6第一次制得氧所形成的正价盐.已知O2PtF6为离子化合物,其中阴离子为PtF6-,下列有关说法正确的是( )
| A. | 该反应证明O2能氧化PtF6 | |
| B. | 22.4LO2参加反应时,转移1mol电子 | |
| C. | O2PtF6中既有离子键又有共价键 | |
| D. | 68.2g O2PtF6中含有1.204×1024个分子 |
18.为了探究AgNO3的热稳定性和氧化性,某化学兴趣小组设计了如下实验.
Ⅰ.AgNO3的热稳定性
利用如图所示的实验装置,加热A 中的AgNO3同体,试管A中有红棕色气体产生,B中无红棕色气体产生,在装置C中收集到无色气体.当反应结束后,测得试管中残留黑色同体Ag.(夹持及加热仪器均省略)
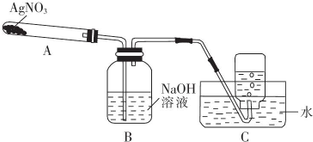
(1)如何检验整套装置的气密性?
(2)C中集气瓶收集的气体为氧气,要收集纯净的该气体,正确的操作是等到导气管中气泡均匀放出时再收集.
(3)AgNO3分解的化学方程式为2AgNO3$\frac{\underline{\;\;△\;\;}}{\;}$2Ag+2NO2↑+O2↑.
Ⅱ.AgNO3的氧化性
将光亮的铁丝伸入盛有AgNO3 溶液的大试管中,一段时间后将铁丝取出.为检验溶液中Fe的氧化产物,
猜测如下:
假设一:Fe被氧化成Fe2+;
假设二:Fe被氧化成Fe3+;
假设三:Fe被氧化成Fe2+ 和Fe3+.
已知:溶液中的Ag+能与SCN-反应,干扰实验.选用如下试剂设计一个实验验证假设三.
可选用的试剂:KSCN溶液、酸性 KMnO4溶液、氯水、盐酸、硝酸、NaCl溶液.
请完成下表:
实验结论:Fe的氧化产物为Fe2+ 和Fe3+.
Ⅰ.AgNO3的热稳定性
利用如图所示的实验装置,加热A 中的AgNO3同体,试管A中有红棕色气体产生,B中无红棕色气体产生,在装置C中收集到无色气体.当反应结束后,测得试管中残留黑色同体Ag.(夹持及加热仪器均省略)

(1)如何检验整套装置的气密性?
(2)C中集气瓶收集的气体为氧气,要收集纯净的该气体,正确的操作是等到导气管中气泡均匀放出时再收集.
(3)AgNO3分解的化学方程式为2AgNO3$\frac{\underline{\;\;△\;\;}}{\;}$2Ag+2NO2↑+O2↑.
Ⅱ.AgNO3的氧化性
将光亮的铁丝伸入盛有AgNO3 溶液的大试管中,一段时间后将铁丝取出.为检验溶液中Fe的氧化产物,
猜测如下:
假设一:Fe被氧化成Fe2+;
假设二:Fe被氧化成Fe3+;
假设三:Fe被氧化成Fe2+ 和Fe3+.
已知:溶液中的Ag+能与SCN-反应,干扰实验.选用如下试剂设计一个实验验证假设三.
可选用的试剂:KSCN溶液、酸性 KMnO4溶液、氯水、盐酸、硝酸、NaCl溶液.
请完成下表:
| 操作 | 现象 | 结论或目的 |
| (1)取少量溶液于试管中,向溶液中加入足量NaCl溶液 | - | 除尽Ag+ |
| (2)取少量上述溶液于试管中,加入KSCN溶液,振荡 | 溶液变血红色 | 存在Fe3+ |
| (3)取(1)中少量上述溶液于试管中,加入酸性KMnO4溶液,振荡 | 血红色消失 | 存在Fe2+ |
19.下列除去杂质的方法正确的是( )
| 选项 | 物质 | 杂质 | 除杂质的方法 |
| A | 二氧化碳 | 一氧化碳 | 点燃 |
| B | 铁粉 | 铜粉 | 过量稀硫酸溶液、过滤 |
| C | FeCl2溶液 | CuCl2 | 过量铁粉、过滤 |
| D | 一氧化碳 | 二氧化碳 | 通过足量灼热的氧化铜 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |

 ,甲的化学式Na2S2O4
,甲的化学式Na2S2O4