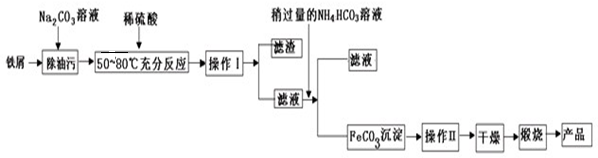
题目内容
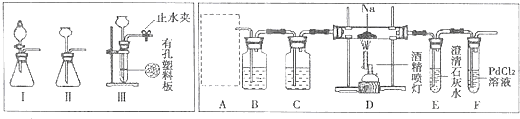
15. 某研究小组为了探究“铁与水蒸气”的反应的产物,进行了下列实验:用如图所示实验装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”(石棉绒高温下不与水和铁反应).
某研究小组为了探究“铁与水蒸气”的反应的产物,进行了下列实验:用如图所示实验装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”(石棉绒高温下不与水和铁反应).(1)如何检查该装置的气密性:将C处导气管末端浸入水槽中,加热A处圆底烧瓶,导管末端出现气泡,停止加热后导管末端出现一段水柱
(2)写出铁与水蒸气反应的化学方程式3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$ Fe3O4+4H2
(3)验证固体产物中铁元素的价态
限选实验仪器与试剂:烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹;1mol/L CuSO4、3mol/L H2SO4、3mol/L HNO3、30%H2O2、0.01mol/L KMnO4、20%KSCN、蒸馏水.
在答题卡上按下表的格式写出实验步骤、预期现象与结论.
| 实验步骤 | 预期现象与结论 | |
| 步骤1 | 取反应后干燥的固体ag于试管中,加入足量的1mol/L CuSO4溶液,充分振荡,经固液分离、洗涤后,再向固体中滴加足量的3mol/L H2SO4,振荡溶解,过滤后将滤液配成250mL溶液,待用. | |
| 步骤2 | 取少量步骤1中滤液于试管中,滴加1~2滴20%KSCN | 溶液变红色,则固体产物含+3价铁 |
| 步骤3 | 取少量步骤1中滤液于试管中,滴加1~2滴0.01mol/L KMnO4 | 溶液紫色褪去,则固体产物含+2价铁 |
分析 (1)检查装置的气密性有加热法和液压法,从本装置的情况看,应该选用加热法;
(2)铁与水蒸气在加热条件下反应生成四氧化三铁和氢气,据此写出反应方程式;
(3)要验证固体产物中铁元素的价态,应该先将固体溶解,考虑到可能有铁单质剩余,会与三价铁离子反应,所以要先除去铁单质,选用的试剂是硫酸铜溶液;剩余的固体则应用稀硫酸溶解,接着确定检验相应离子的试剂,三价铁离子用的是硫氰化钾溶液,而检验二价铁则从限选试剂中只能用高锰酸钾溶液,利用二价铁离子的还原性,据此进行解答.
解答 解:(1)利用加热法检验该装置气密性,将C处将导管伸入水槽,并微热A处圆底烧瓶,现象是导管末端出现气泡,停止加热后导管末端出现一段水柱,则气密性良好,
故答案为:将C处导气管末端浸入水槽中,加热A处圆底烧瓶,导管末端出现气泡,停止加热后导管末端出现一段水柱;
(2)铁与水蒸气在高温下反应生成四氧化三铁和氢气,反应的化学方程式为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,
故答案为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;
(3)验证固体产物中铁元素的价态,先要将固体溶解,但考虑到可能有铁单质剩余,会和三价铁离子反应,所以要先除去铁单质,选用的试剂是硫酸铜溶液,然后,剩余的固体则应用稀硫酸溶解(因为硝酸的氧化性会氧化二价铁),接着确定检验相应离子的试剂,三价铁离子用的是硫氰化钾溶液,而检验二价铁则从限选试剂中只能用高锰酸钾溶液,利用二价铁离子的还原性,
故答案为:
| 实验步骤 | 预期现象与结论 | |
| 步骤1 | 3mol/L H2SO4 | |
| 步骤2 | 滴加1~2滴20%KSCN | 溶液变红色,则固体产物含+3价铁 |
| 步骤3 | 滴加1~2滴0.01mol/L KMnO4 | 溶液紫色褪去,则固体产物含+2价铁 |
点评 本题考查铁及其化合物性质,题目难度中等,涉及铁与水蒸气的反应、气密性的检验、实验方案设计、二价铁、三价铁离子的检验方法等知识,试题知识点较多、充分考查学生的分析、理解能力及化学实验能力.

 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案| A. | 用25 ml的碱式滴定管量取14.8 ml的KMnO4溶液 | |
| B. | 用100ml量筒量取5.2 ml盐酸 | |
| C. | 用托盘天平称取25.20 g NaCl | |
| D. | 用100 ml容量瓶配制80 ml 0.1 mol•L一的盐酸 |

已知:①KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O
②I2+2Na2S2O3=2NaI+Na2S4O6(无色)
某同学想定量测定此加碘盐中碘元素的含量,进行以下实验:
步骤1:称取ag市售食盐,配成溶液,全部转移至锥形瓶中,
加入适量新制KI溶液,滴入几滴稀硫酸,溶液变黄色,再加入3滴淀粉溶液.
步骤2:取一支50mL碱式滴定管,用bmol•L-1的新制Na2S2O3溶液润洗2~3次后,装满溶液,调节液面高度至0刻度.
步骤3:开始滴定直至终点,重复操作2~3次,实验数据记录如下:
| 编号 | 碱式滴定管读数 | 消耗体积(mL) | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 0 | 如图2 | |
| 2 | 0 | 23.98 | 23.98 |
| 3 | 0 | 24.02 | 24.02 |
(2)滴定终点的判断方法溶液颜色恰好由蓝色变为无色且半分钟内不褪色.
(3)经过计算,此碘盐碘元素的含量为$\frac{508000b}{a}$mgmg•kg-1(用含a、b的最简表达式表示).
(4)下列操作可能会导致测量结果偏低的是CD.
A.步骤1中称取食盐时将砝码放在左盘,食盐放在放在右盘,游码读数为0.5g
B.步骤1所配食盐溶液未完全转移至锥形瓶
C.步骤2中滴定管洗涤后未润洗
D.步骤3滴定前滴定管尖嘴处有气泡,滴定后气泡消失
(5)请在答题纸的方框内画出正在排气泡的碱式滴定管(仅画出刻度以下部分)
(1)实验目的:探究同一主族元素性质的递变规律
(2)实验用品:药品:氯水、溴水、溴化钠溶液、碘化钾溶液、四氯化碳.
仪器:①试管;②胶头滴管(请填写两件主要的玻璃仪器)
(3)实验内容:
| 序号 | 实验方案 | 实验现象 |
| ① | 将少量氯水滴入盛有少量NaBr溶液的试管中,振荡;再滴入少量四氯化碳,振荡 | 加入氯水后,溶液由无色变为橙色,滴入四氯化碳后,水层颜色变浅,四氯化碳层(下层)变为橙红色 |
| ② | 将少量溴水滴入盛有少量KI溶液的试管中,振荡;再滴入少量四氯化碳,振荡 | 加入溴水后,溶液由无色变为黄色,滴入四氯化碳后,水层颜色变浅,四氯化碳层(下层)变为紫色 |
(5)问题和讨论:请用结构理论简单说明得出上述结论的原因.同一主族元素,自上而下,元素原子的电子层数增多,原子半径增大,原子核对最外层电子的吸引力逐渐减弱.
| A. | ①②③④ | B. | ④③②① | C. | ③②④① | D. | ③①②④ |