题目内容
一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如下图所示。已知: pM=" -lg" c(M),pc(CO32-)= -lgc(CO32-)。下列说法正确的是 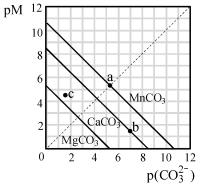
| A.MgCO3、CaCO3、MnCO3的Ksp依次增大 |
| B.a 点可表示MnCO3的饱和溶液,且c(Mn2+)= c(CO32-) |
| C.b 点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO32-) |
| D.c 点可表示MgCO3的不饱和溶液,且c(Mg2+)﹥c(CO32-) |
B
解析试题分析:首先要理解pM=-lgc(M),p(CO32-)=-lgc(CO32-)的含义以及图像横坐标、纵坐标所代表的含义。c(M)、c(CO32-)越大,则pM、p(CO32-)越小。类似于pH和c(H+)之间的对应关系。同时所有线上的点都代表饱和溶液。A. 作一条平行于横坐标的辅助线,当pM相同时,MgCO3、CaCO3、MnCO3 的p(CO32- )依次增大,即c(CO32- )依次减小,所以MgCO3、CaCO3、MnCO3 的Ksp依次减小。错误。B. a点为饱和溶液,pM和p(CO32-)相等,c(Mn2+)=c(CO32-)。正确。C. b点为饱和溶液,由于p(CO32-)=7>p(Ca2+)=1.5,所以c(CO32- )<c(Ca2+)。错误。D. c点不在线上,是不饱和溶液,由于p(Mg2+)>p(CO32-),所以c(Mg2+)<c(CO32-)。错误。
考点:考查沉淀溶解平衡的知识。

下列有关中和滴定的操作:①用标准液润洗滴定管;②往滴定管内注入标准溶液;③检查滴定管是否漏水;④滴定;⑤滴加指示剂于待测液;⑥洗涤。正确的操作顺序是
| A.⑥③①②⑤④ | B.⑤①②⑥④③ | C.⑤④③②①⑥ | D.③①②④⑤⑥ |
下列物质属于弱电解质的是
| A.HNO3 | B.NaOH | C.KCl | D.CH3COOH |
下列溶液,按 由小到大顺序排列的是
由小到大顺序排列的是
① 溶液 ②
溶液 ②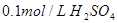 溶液
溶液
③ 溶液 ④
溶液 ④ 溶液
溶液
| A.①②④③ | B.②①④③ | C.③④①② | D.④③②① |
下列各溶液中,相关微粒物质的量浓度关系不正确的是
| A.0.1 mol·L-1NaHCO3溶液中:c(OH-)=c(H+)+c(H2CO3)-c(CO32-) |
| B.0.1 mol·L-1NH4Cl溶液中:c(Cl-)=c(NH4+)+c(NH3·H2O)=0.1 mol·L-1 |
| C.pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+)+c(M+)=c(OH-)+c(A-) |
| D.常温下,浓度为0.1 mol·L-1 NaHSO3溶液的pH<7:c(Na+)>c(HSO3-)>c(SO32-)> c(H+) |
为了除去MgCl2酸性溶液中的 Fe3+,可在加热搅拌条件下加入一种试剂,过滤后,在向滤液中加入适量的盐酸,这种试剂是
| A.NaOH | B.NH3·H2O | C.MgCl2 | D.MgCO3 |
已知温度T时水的离子积常数为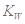 。该温度下,将浓度为amol/L的一元酸HA与b mol/L的一元碱BOH等体积混合,可判定该溶液呈中性的依据是
。该温度下,将浓度为amol/L的一元酸HA与b mol/L的一元碱BOH等体积混合,可判定该溶液呈中性的依据是
| A.a=b |
| B.混合溶液的pH=7 |
C.混合溶液中,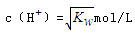 |
D.混合溶液中,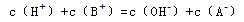 |