题目内容
下列溶液,按 由小到大顺序排列的是
由小到大顺序排列的是
① 溶液 ②
溶液 ② 溶液
溶液
③ 溶液 ④
溶液 ④ 溶液
溶液
| A.①②④③ | B.②①④③ | C.③④①② | D.④③②① |
B
解析试题分析:酸中C(H+)越大,溶液的pH就越小。①是一元强酸,②是二元强酸,④是一元弱酸,③是一元强碱。当酸的浓度相等时,二元强酸的氢离子的浓度大于一元强酸的,一元强酸的大于一元弱酸的,碱中的氢离子浓度最小,因此C(H+)由大到小的顺序是②①④③ ,所以pH由小到大顺序排列②① ④ ③,选项是B。
考点:考查溶液中的pH 的大小排列顺序的知识。

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
下表是稀硫酸与某金属反应的实验数据:
| 实验 序号 | 金属质 量/g | 金属 状态 | c(H2SO4)/ (mol·L-1) | V(H2SO4) /mL | 溶液温度/℃ | 金属消失 的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉 末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉 末 | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 丝 | 1.1 | 50 | 30 | 44 | 40 |
分析上述数据,完成下列问题:
(1)实验4和5表明________________对反应速率有影响,________反应速率越快,能表明同一规律的实验还有________。(填实验序号)
(2)仅表明反应物浓度对反应速率产生影响的实验有________。(填实验序号)
(3)本实验中影响反应速率的其他因素还有________,其实验序号是________。
(4)实验中的所有反应,反应前后溶液的温度变化值(约15 ℃)相近,推测其原因:
_____________________________________________
某探究小组在某温度下测定溶液的pH时发现:0.01mol·L-1的NaOH溶液中,由水电离出的c(H+)·c(OH-)=10-22,则该小组在该温度下测得0.1mol·L-1NaOH溶液的pH应为
| A.13 | B.12 | C.11 | D.10 |
已知,25℃时有关弱酸的电离平衡常数如下: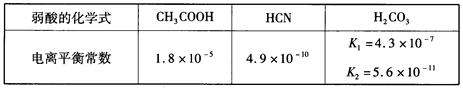
则下列有关说法正确的是( )
| A.等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) |
| B.a mol·L-1 HCN溶液与b mol·L-1NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则b一定大于a |
| C.向冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离度、pH均先增大后减小 |
| D.等物质的量NaHCO3和Na2CO3的混合溶液中,一定存在: c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如下图所示。已知: pM=" -lg" c(M),pc(CO32-)= -lgc(CO32-)。下列说法正确的是 
| A.MgCO3、CaCO3、MnCO3的Ksp依次增大 |
| B.a 点可表示MnCO3的饱和溶液,且c(Mn2+)= c(CO32-) |
| C.b 点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO32-) |
| D.c 点可表示MgCO3的不饱和溶液,且c(Mg2+)﹥c(CO32-) |
若醋酸用HAc表示,则在0.1mol·L-1 NaAc溶液中,下列离子浓度关系正确的是
| A.c(Na+)= c(Ac—)+c(HAc) |
| B.c(Na+)+c(OH—)= c(Ac—)+c(H+) |
| C.c(Na+)>c(OH—) > c(Ac—) > c(H+) |
| D.c(Na+)> c(Ac—)> c(H+)> c(OH—) |
下列叙述中,正确的是
A.用惰性电极电解 溶液分别得到单质 溶液分别得到单质 和Cl2 和Cl2 |
B.常温下,某溶液中由水电离出的 ,该溶液一定呈酸性 ,该溶液一定呈酸性 |
C. 溶液和 溶液和 溶液加热蒸干、灼烧都得到 溶液加热蒸干、灼烧都得到 |
| D.在AgBr饱和溶液中加入AgNO3溶液,达到平衡时,溶液中Br-浓度降低 |
下列事实能说明NH3·H2O一定是弱电解质的是
①常温下,NH3·H2O溶液能使酚酞变红; ②用NH3·H2O溶液做导电性实验,灯泡很暗;
③常温下,0.1mol / L氯化铵溶液的pH约为5
④常温下,体积相同且pH相同的NH3·H2O溶液和NaOH溶液,与相同浓度的HCl溶液中和时,消耗HCl溶液的体积:前者>后者
| A.①②③④ | B.②③④ | C.③④ | D.②④ |
下列关于盐类水解原理的叙述正确的是( )
| A.一定生成弱酸 | B.水的电离平衡不受影响 |
| C.水解过程中要吸收热量 | D.溶液的pH一定变大 |