题目内容
下列有关中和滴定的操作:①用标准液润洗滴定管;②往滴定管内注入标准溶液;③检查滴定管是否漏水;④滴定;⑤滴加指示剂于待测液;⑥洗涤。正确的操作顺序是
| A.⑥③①②⑤④ | B.⑤①②⑥④③ | C.⑤④③②①⑥ | D.③①②④⑤⑥ |
A
解析试题分析:有关中和滴定的操作,首先是洗涤滴定管,然后是检查滴定管是否漏水;再向滴定管中装标准溶液,然后向待测溶液中滴加指示剂;最后进行滴定。因此顺序是⑥③①②⑤④,选项是A。
考点:考查有关中和滴定的操作的步骤是知识。

汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体。
(1)汽车尾气中CO、NO2气体在一定条件下可以发生反应:
4CO(g)+2NO2(g) 4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1
4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1
①恒温恒容条件下,不能说明该反应已达到平衡状态的是________(填序号);
A.容器内混合气体颜色不再变化 B.容器内的压强保持不变
C.2v逆(NO2)=v正(N2) D.容器内混合气体密度保持不变
②能使该反应的反应速率增大,且平衡向逆反应方向移动的是________(填序号);
A.及时分离出CO2 B.适当升高温度
C.减小容器体积使体系压强增大 D.选择高效催化剂
③对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是________(填序号);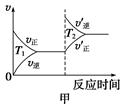
(2)汽车尾气中CO与H2O(g)在一定条件下可以发生反应:CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0;820 ℃时在甲、乙、丙三个恒容密闭容器中,起始时按照右表进行投料,达到平衡状态时K=1.0。
CO2(g)+H2(g) ΔH<0;820 ℃时在甲、乙、丙三个恒容密闭容器中,起始时按照右表进行投料,达到平衡状态时K=1.0。
| 起始物质的量 | 甲 | 乙 | 丙 |
| n(H2O)/mol | 0.10 | 0.20 | 0.20 |
| n(CO)/mol | 0.10 | 0.10 | 0.20 |
①该反应的平衡常数表达式为___________;平衡时,甲容器中CO的转化率= ;
②平衡时,比较下列容器中CO的转化率:乙 甲(填“>”、“=”或“<”,下同);丙 甲。
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好PH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
【实验设计】控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比试验。
(1)请完成以下实验设计表(表中不要留空格)。
| 实验 编号 | 实验目的 | T/K | pH | c/10-3mol·L-1 | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参考 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | | | | |
| ③ | | 298 | 10 | 6.0 | 0.30 |
【数据处理】实验测得p-CP的浓度随时间变化的关系如下图。
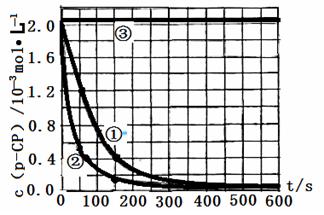
(2)请根据上图实验①曲线,计算降解反应在50~150s内的反应速率:
υ(p-CP)= mol·L-1·s-1
(3)实验①、②表明温度升高,降解反应速率增大。但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:
。
(4)实验③得出的结论是:pH等于10时, 。
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法 。
下列事实(常温下)不能说明醋酸是弱电解质的是
| A.醋酸钠溶液pH>7 |
| B.醋酸溶液能溶解碳酸钙 |
| C.0.1mol·L-1醋酸溶液pH=2.9 |
| D.pH=1的醋酸溶液稀释100倍后pH<3 |
25C时,用浓度为0.1000 mol/L的NaOH溶液滴定20. 00 mL 0 .1000 mol·L-1的
CH3COOH.。滴定曲线如图所示。下列分析错误的是
| A.C点的溶液:c(CH3COO一)+c(CH.3COOH)>c(Na+) |
| B.B点的溶液c (CH3COO一)>c(Na+)>c(H+)> c(OH-) |
| C.A点的纵坐标值为l |
| D.D点溶液2c(CH3COOH)十c(H+) =c(OH—)—c(CH3COO—) |
某探究小组在某温度下测定溶液的pH时发现:0.01mol·L-1的NaOH溶液中,由水电离出的c(H+)·c(OH-)=10-22,则该小组在该温度下测得0.1mol·L-1NaOH溶液的pH应为
| A.13 | B.12 | C.11 | D.10 |
下列有关问题与盐的水解无关的是( )
| A.NH4Cl与ZnCl2溶液可作焊接金属时的除锈剂 |
| B.用NaHCO3与Al2(SO4)3两种溶液可制成泡沫灭火剂 |
| C.常温下测得NaHSO3溶液的pH小于7 |
| D.实验室盛放Na2CO3溶液的试剂瓶不能用磨口玻璃塞 |
一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如下图所示。已知: pM=" -lg" c(M),pc(CO32-)= -lgc(CO32-)。下列说法正确的是 
| A.MgCO3、CaCO3、MnCO3的Ksp依次增大 |
| B.a 点可表示MnCO3的饱和溶液,且c(Mn2+)= c(CO32-) |
| C.b 点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO32-) |
| D.c 点可表示MgCO3的不饱和溶液,且c(Mg2+)﹥c(CO32-) |
有①Na2CO3溶液、②CH3COONa溶液、③NaOH溶液各25mL,物质的量浓度均为0.1mol/L,下列说法正确的是( )
| A.三种溶液pH的大小顺序是③>②>① |
| B.若将三种溶液稀释相同倍数,pH变化最大的是② |
| C.若分别加入25mL 0.1mol/L盐酸后,pH最大的是① |
| D.若三种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>② |