题目内容
下列各溶液中,相关微粒物质的量浓度关系不正确的是
| A.0.1 mol·L-1NaHCO3溶液中:c(OH-)=c(H+)+c(H2CO3)-c(CO32-) |
| B.0.1 mol·L-1NH4Cl溶液中:c(Cl-)=c(NH4+)+c(NH3·H2O)=0.1 mol·L-1 |
| C.pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+)+c(M+)=c(OH-)+c(A-) |
| D.常温下,浓度为0.1 mol·L-1 NaHSO3溶液的pH<7:c(Na+)>c(HSO3-)>c(SO32-)> c(H+) |
D
解析试题分析:A、碳酸氢钠溶液中存在电荷守恒和物料守恒,根据电荷守恒得c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),根据物料守恒得c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3),所以得c(OH-)=c(H+)+c(H2CO3)-c(CO32-),故A正确;B、任何电解质溶液中都存在物料守恒,根据物料守恒得c(Cl-)=c(NH4+)+c(NH3?H2O)=0.1mol?L-1,故B正确;C、任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(H+)+c(M+)=c(OH-)+c(A-),故C正确;D、常温下,浓度为0.1mol?L-1 NaHSO3溶液的pH<7,说明HSO3-电离程度大于水解程度,HSO3-和水都电离出氢离子,只有HSO3-电离出SO32-,所以c(SO32-)<c(H+),故D错误。
考点:本题考查离子浓度比较。

Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好PH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
【实验设计】控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比试验。
(1)请完成以下实验设计表(表中不要留空格)。
| 实验 编号 | 实验目的 | T/K | pH | c/10-3mol·L-1 | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参考 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | | | | |
| ③ | | 298 | 10 | 6.0 | 0.30 |
【数据处理】实验测得p-CP的浓度随时间变化的关系如下图。
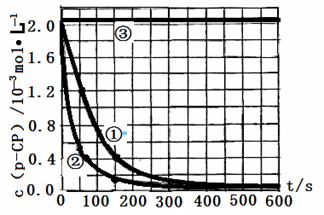
(2)请根据上图实验①曲线,计算降解反应在50~150s内的反应速率:
υ(p-CP)= mol·L-1·s-1
(3)实验①、②表明温度升高,降解反应速率增大。但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:
。
(4)实验③得出的结论是:pH等于10时, 。
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法 。
下列有关问题与盐的水解无关的是( )
| A.NH4Cl与ZnCl2溶液可作焊接金属时的除锈剂 |
| B.用NaHCO3与Al2(SO4)3两种溶液可制成泡沫灭火剂 |
| C.常温下测得NaHSO3溶液的pH小于7 |
| D.实验室盛放Na2CO3溶液的试剂瓶不能用磨口玻璃塞 |
一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如下图所示。已知: pM=" -lg" c(M),pc(CO32-)= -lgc(CO32-)。下列说法正确的是 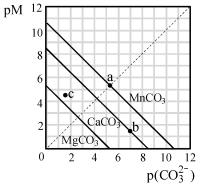
| A.MgCO3、CaCO3、MnCO3的Ksp依次增大 |
| B.a 点可表示MnCO3的饱和溶液,且c(Mn2+)= c(CO32-) |
| C.b 点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO32-) |
| D.c 点可表示MgCO3的不饱和溶液,且c(Mg2+)﹥c(CO32-) |
25℃时,水中存在电离平衡: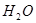

 。下列叙述正确的是
。下列叙述正确的是
A.将水加热,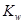 增大, 增大, 不变 不变 |
B.向水中加入少量NaHSO4固体,c(H+)增大, 不变 不变 |
C.向水中加入少量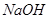 固体,平衡逆向移动, 固体,平衡逆向移动,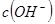 降低 降低 |
D.向水中加入少量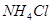 固体,平衡正向移动, 固体,平衡正向移动,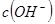 增大 增大 |
下列叙述中,正确的是
A.用惰性电极电解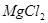 溶液分别得到单质 溶液分别得到单质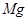 和Cl2 和Cl2 |
B.常温下,某溶液中由水电离出的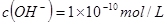 ,该溶液一定呈酸性 ,该溶液一定呈酸性 |
C.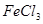 溶液和 溶液和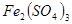 溶液加热蒸干、灼烧都得到 溶液加热蒸干、灼烧都得到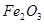 |
| D.在AgBr饱和溶液中加入AgNO3溶液,达到平衡时,溶液中Br-浓度降低 |
常温下,0.1mol·L-1CH3COONa溶液中,微粒浓度间关系正确的是
| A.c(Na+)=c(CH3COO-) >c(OH-)=c(H+) |
| B.c(OH-)=c(H+)+ c(CH3COOH) |
| C.c(Na+) + c(H+)= c(CH3COO-) +c(OH-) |
| D.c(CH3COOH) + c(CH3COO-) = c(Na+)+ c(H+) |
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如下图,下列判断错误的是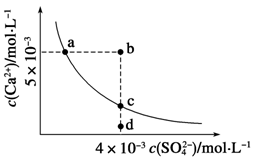
| A.a、c两点均可以表示常温下CaSO4溶于水所形成的饱和溶液 |
| B.a点对应的Ksp不等于c点对应的Ksp |
C.b点将有沉淀生成,平衡后溶液中c(SO )一定等于3×10-3 mol·L-1 )一定等于3×10-3 mol·L-1 |
| D.向d点溶液中加入适量CaCl2固体可以变到c点 |
有①Na2CO3溶液、②CH3COONa溶液、③NaOH溶液各25mL,物质的量浓度均为0.1mol/L,下列说法正确的是( )
| A.三种溶液pH的大小顺序是③>②>① |
| B.若将三种溶液稀释相同倍数,pH变化最大的是② |
| C.若分别加入25mL 0.1mol/L盐酸后,pH最大的是① |
| D.若三种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>② |