题目内容
常温下,0.1mol·L-1某一元酸(HA)溶液中c(OH-)/c(H+)=1×10-8,下列叙述正确的是( )
A.由pH=3的HA与pH=11的NaOH溶液等体积混合,溶液中c(Na+)>c(Ac—)>c(OH―)>c(H+)
B.0.1mol·L-1HA溶液与0.05mol·L-1NaOH溶液等体积混合后所得溶液中,
2c(H+)+c(HA)=c(A-)+c(OH-)
C.该溶液中由水电离出的c(H+)=1×10-11 mol·L-1
D.浓度均为0.1mol/L的HA和NaA溶液等体积混合后,若溶液呈酸性,则
c(A-)>c(HA)>c(Na+)>c(H+)>c(OH-)
D
解析试题分析:常温下,0.1mol·L-1某一元酸(HA)溶液中c(OH-)/c(H+)=1×10-8,c(H+)=1×10-3,该酸是弱酸。A.由pH=3的HA与pH=11的NaOH溶液等体积混合,由于溶液中还存在酸分子的电离作用,所以溶液中c c(A—)>(Na+)>c(H+) > c(OH―),错误;B.0.1mol·L-1HA溶液与0.05mol·L-1NaOH溶液等体积混合后所得溶液中是HA与NaA等浓度等体积的混合溶液,根据物料守恒可得2c(Na+)= c(HA)+c(A-),根据电荷守恒可得c(H+)+c(Na+)=c(A-)+c(OH-),两式整理可得:2c(H+)+c(HA)=c(A-)+2c(OH-),错误;D.浓度均为0.1mol/L的HA和NaA溶液等体积混合后,若溶液呈酸性,则HA的电离作用大于NaA的水解作用,故有 c(A-)>c(HA)>c(Na+)>c(H+)>c(OH-),正确。
考点:考查溶液中离子浓度的关系的知识。

 初中暑期衔接系列答案
初中暑期衔接系列答案某探究小组用金属铝分别与稀盐酸或稀硫酸反应的方法研究金属与不同酸反应的差异及影响反应速度的因素。
实验药品:2.0 mol/L盐酸、4.0 mol/L盐酸、2.0 mol/L硫酸、4.0 mol/L硫酸、相同大小的铝片和铝粉(金属表面氧化膜都已除去);每次实验各种酸的用量均为50.0 mL,金属用量均为9.0 g。
Ⅰ.甲同学用铝片分别和稀盐酸、稀硫酸反应,实验及其现象如下:
| 反应进程 (分钟) | 1 | 2 | 5 | 15 | 20 |
| 4.0 mol/L 盐酸 | 少量气泡 | 较多气泡 | 大量气泡 | 反应剧烈 | 铝片耗尽 |
| 2.0 mol/L 硫酸 | 无明显现象 | 极少量 气泡 | 少量气泡 | ||
| 4.0 mol/L 硫酸 | 无明显现象 | 少量气泡 | 有比较连续的气泡 | ||
请回答下列问题:
(1)写出铝与盐酸反应的离子方程式: 。
(2)反应在1~15min内,铝与盐酸的反应速率逐渐增大,其原因是 。
(3)根据以上探究“铝与稀盐酸和稀硫酸的反应速率存在差异的原因”,你能对原因作出哪些假设或猜想: (写出一种即可)。
Ⅱ.乙同学设计了如下影响反应速率因素的实验。请你根据实验目的帮助该同学完成以下实验设计表:
| 实验目的 | 实验 编号 | 温度 /℃ | 金属铝的 形态 | 盐酸浓度 /mol·L-1 |
| 1.实验①和②探究盐酸浓度对该反应速率的影响; 2.实验①和③探究温度对该反应速率的影响; 3.实验①和④探究金属规格(铝片、 铝粉)对该反应速率的影响 | ① | 25 | 铝片 | 4.0 |
| ② | | | | |
| ③ | | | | |
| ④ | | | |
下列事实(常温下)不能说明醋酸是弱电解质的是
| A.醋酸钠溶液pH>7 |
| B.醋酸溶液能溶解碳酸钙 |
| C.0.1mol·L-1醋酸溶液pH=2.9 |
| D.pH=1的醋酸溶液稀释100倍后pH<3 |
某探究小组在某温度下测定溶液的pH时发现:0.01mol·L-1的NaOH溶液中,由水电离出的c(H+)·c(OH-)=10-22,则该小组在该温度下测得0.1mol·L-1NaOH溶液的pH应为
| A.13 | B.12 | C.11 | D.10 |
下列有关问题与盐的水解无关的是( )
| A.NH4Cl与ZnCl2溶液可作焊接金属时的除锈剂 |
| B.用NaHCO3与Al2(SO4)3两种溶液可制成泡沫灭火剂 |
| C.常温下测得NaHSO3溶液的pH小于7 |
| D.实验室盛放Na2CO3溶液的试剂瓶不能用磨口玻璃塞 |
已知,25℃时有关弱酸的电离平衡常数如下: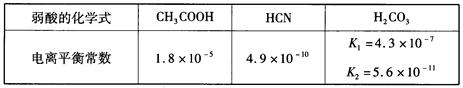
则下列有关说法正确的是( )
| A.等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) |
| B.a mol·L-1 HCN溶液与b mol·L-1NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则b一定大于a |
| C.向冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离度、pH均先增大后减小 |
| D.等物质的量NaHCO3和Na2CO3的混合溶液中,一定存在: c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如下图所示。已知: pM=" -lg" c(M),pc(CO32-)= -lgc(CO32-)。下列说法正确的是 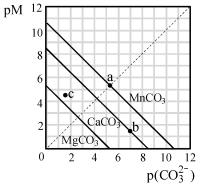
| A.MgCO3、CaCO3、MnCO3的Ksp依次增大 |
| B.a 点可表示MnCO3的饱和溶液,且c(Mn2+)= c(CO32-) |
| C.b 点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO32-) |
| D.c 点可表示MgCO3的不饱和溶液,且c(Mg2+)﹥c(CO32-) |
下列叙述中,正确的是
A.用惰性电极电解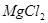 溶液分别得到单质 溶液分别得到单质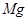 和Cl2 和Cl2 |
B.常温下,某溶液中由水电离出的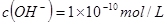 ,该溶液一定呈酸性 ,该溶液一定呈酸性 |
C.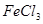 溶液和 溶液和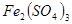 溶液加热蒸干、灼烧都得到 溶液加热蒸干、灼烧都得到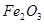 |
| D.在AgBr饱和溶液中加入AgNO3溶液,达到平衡时,溶液中Br-浓度降低 |
 Cu2+(aq)+2OH-(aq),在常温下Ksp=2×10-20。在常温下如果要生成Cu(OH)2沉淀,需要向0.02 mol/L的CuSO4溶液中加入碱来调整溶液的pH,应使溶液的pH大于( )
Cu2+(aq)+2OH-(aq),在常温下Ksp=2×10-20。在常温下如果要生成Cu(OH)2沉淀,需要向0.02 mol/L的CuSO4溶液中加入碱来调整溶液的pH,应使溶液的pH大于( )