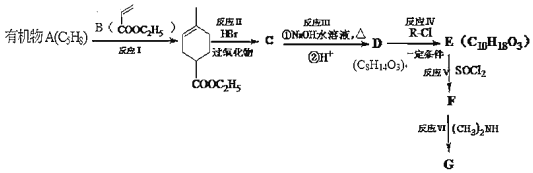
题目内容
【题目】乙烯与水加成制备乙醇的能量变化过程如下图所示。下列说法不正确的是
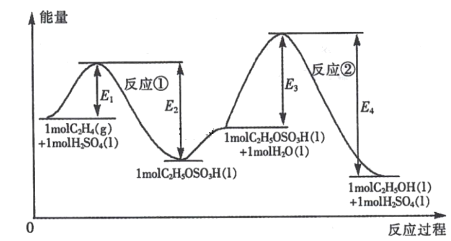
A.H2SO4是该合成过程的催化剂
B.合成过程的速率由反应②决定
C.反应①和反应②均为放热反应
D.C2H4 (g) +H2O(1) =C2H5OH(l )△H =(E1- E4)kJ mol-1
【答案】D
【解析】
A.1molH2SO4在反应①中和乙烯发生了加成反应,在反应②中又生成了1molH2SO4,所以H2SO4是该合成过程的催化剂,A正确;
B.反应②的活化能大于反应①,活化能越大,反应速率越慢,所以反应②速率慢,合成过程的速率由反应②决定,B正确;
C.从图中可以看出,反应①和反应②的反应物的总能量都高于生成物的总能量,均为放热反应,C正确;
D.从图中可以看出,总反应C2H4 (g) +H2O(1) =C2H5OH(l )的△H =( E1- E2+E3- E4)kJ mol-1,D错误;
故选D。

练习册系列答案
相关题目
【题目】根据下列实验操作和现象得出的结论正确的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 将电石与水反应产生的气体通入酸性高锰酸钾溶液 | 溶液紫色褪去 | 证明有乙炔生成 |
B | 取CH3COONa溶液于试管中并加入几滴酚酞,再加热 | 溶液红色加深 | CH3COONa溶液显碱性且存在水解平衡 |
C | 向蔗糖溶液中加入稀硫酸,加热几分钟后加入新制Cu(OH)2悬浊液,加热煮沸 | 无红色沉淀生成 | 蔗糖没有发生水解反应生成葡萄糖 |
D | 向Na2S2O3溶液中滴加H2SO4溶液至过量 | 一段时间后溶液变浑浊 | Na2S2O3在该反应中只作氧化剂 |
A.AB.BC.CD.D