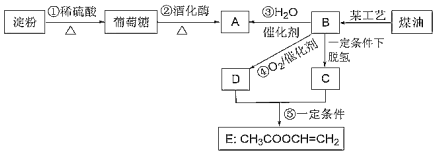
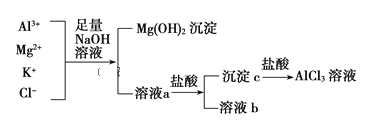
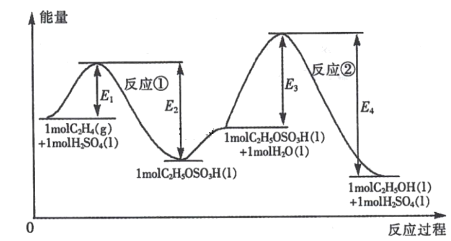
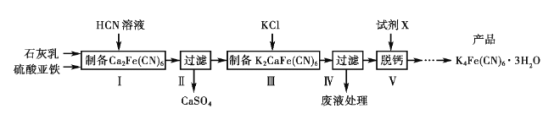
题目内容
【题目】芴酮可用作工程塑料的改进剂。某芴酮可通过下列反应得到:
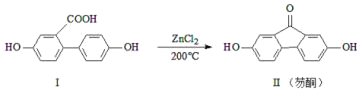
①化合物Ⅱ中含氧官能团为_____和_____(写名称)。
②鉴别化合物Ⅰ和化合物Ⅱ可用的试剂为_____(写化学式)。
③1mol化合物Ⅰ最多可与_____molNaOH完全反应。
【答案】(酚)羟基 羰基 NaHCO3 3
【解析】
①根据物质的结构简式判断其含氧官能团;
②从I、II含有的官能团的不同,结合官能团的性质选择使用的鉴别试剂;
③羧基、酚羟基都可以与NaOH发生反应。
①根据化合物Ⅱ的结构可知,其中含氧官能团为酚羟基和羰基;
②两种物质中都含有酚羟基,但化合物Ⅰ还含有羧基,具有酸的通性,可用NaHCO3溶液鉴别,向其中加入NaHCO3溶液,有气泡产生的物质是 ,加入碳酸氢钠溶液,无现象的是
,加入碳酸氢钠溶液,无现象的是 ;
;
③化合物Ⅰ中酚羟基和羧基都可与氢氧化钠溶液反应,由于I中含有2个酚羟基和1个羧基,因此1mol化合物I可与3mol氢氧化钠反应。

【题目】K、Al、Si、Cu、Ni均为重要的合金材料,在工业生产、科技、国防领域有着广泛的用途,请回答下列问题:
(1)K元素处于元素同期表的_____区。
(2)下列状态的铝中,电离最外层一个电子所需能量最大的是______(填标号)。
A. [Ne]![]() B.[Ne]
B.[Ne]![]()
![]() C.[Ne]
C.[Ne] ![]()
![]() D. [Ne]
D. [Ne]![]()
![]()
![]()
3s 3s 3p 3s 3p 3s 3p 3p
(3)从核外电子排布角度解释高温下Cu2O比CuO更稳定的原因是_____________。
(4)一些化合物的熔点如下表所示:
化合物 | NaCl | KCl | SiO2 |
熔点/°C | 801 | 770 | 1723 |
解释表中化合物之间熔点差异的原因________________________________。
(5)NiSO4溶于氨水形成[Ni(NH3)6]SO4。
①N、O、S三种元素中电负性最大的是_______。
②写出一种与[Ni(NH3)6]SO4中的阴离子互为等电子体的分子的分子式_________。
③1mol[Ni(NH3)6]SO4中含有δ键的数目为___________。
④NH3的VSEPR模型为____;NH3、SO42-的中心原子的杂化类型分别为___、___。
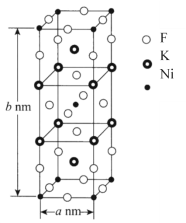
(6)K、Ni、F三种元素组成的一种晶体的长方体晶胞结构如图所示。若NA为阿伏加德罗常数的值,该晶体的密度ρ=______g·cm-3(用代数式表示)。