题目内容
14.下列反应的离子方程式书写正确的是( )| A. | 单质钠投入水中:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 纯碱溶液与盐酸反应:CO${\;}_{3}^{2-}$+2H+═CO2↑+H2O | |
| C. | 氢氧化铜与盐酸反应:H++OH-═H2O | |
| D. | 稀硫酸和氢氧化钡溶液反应:Ba2++OH-+H++SO${\;}_{4}^{2-}$═BaSO4↓+H2O |
分析 A.钠与水反应生成氢氧化钠和氢气;
B.纯碱为碳酸钠,碳酸钠与盐酸反应生成氯化钠、二氧化碳气体和水;
C.氢氧化铜为难溶物,离子方程式中氢氧化铜不能拆开;
D.氢离子与氢氧根离子的系数不满足硫酸和氢氧化钡的化学式组成.
解答 解:A.单质钠投入水中生成氢氧化钠和氢气,反应的离子方程式为:2Na+2H2O═2Na++2OH-+H2↑,故A正确;
B.纯碱为碳酸钠,碳酸钠与盐酸反应的离子方程式为:CO32-+2H+═CO2↑+H2O,故B正确;
C.氢氧化铜不能拆开,应该保留化学式,正确的离子方程式为:Cu(OH)2+2H+=2H2O+Cu2+,故C错误;
D.稀硫酸与氢氧化钡溶液反应生成硫酸钡沉淀和水,正确的离子方程式为:2OH-+2H++Ba2++SO42-=2H2O+BaSO4↓,故D错误;
故选AB.
点评 本题考查了离子方程式的书写判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.下列关于电离常数的说法正确的是( )
| A. | 电离常数随着弱电解质的浓度增大而增大 | |
| B. | CH3COOH的电离常数表达式为Ka=$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}$ | |
| C. | CH3COOH溶液中加入少量CH3COONa溶液,电离常数减小 | |
| D. | 电离常数只与温度有关,与浓度无关 |
2.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 无色溶液中:Al3+、Cl-、MnO4-、SO42- | |
| B. | 含有大量Fe3+的溶液中:Na+、Mg2+、NO3-、SCN- | |
| C. | 0.1 mol•L-1AgNO3溶液:H+、K+、SO42-、I- | |
| D. | 使酚酞变红色的溶液:CO32-、Cl-、F-、K+ |
19.称取两份铝粉,第一份加入足量的盐酸,第二份加入足量的NaOH溶液.若生成的氢气的质量相同,则两份铝粉的质量比为( )
| A. | 1:1 | B. | 2:3 | C. | 3:2 | D. | 1:6 |
15.工业接触法制硫酸没有涉及的设备是( )
| A. | 沸腾炉 | B. | 接触室 | C. | 高炉 | D. | 吸收塔 |
 反应类型:加聚反应
反应类型:加聚反应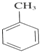 +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$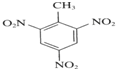 +3H2O.
+3H2O.