题目内容
4.钠、氯及其化合物有如下转化关系,请按要求填空:
(1)金属钠的密度比水小,实验室中金属钠通常保存在煤油中.一小块金属钠投入水中的反应方程式是2Na+2H2O=2NaOH+H2↑.
(2)Na2O2是淡黄色的固体,Na2O2的重要用途是做呼吸面具的供氧剂,有关反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2.
(3)通常情况下,为了防止污染环境,在做完实验后,多余的氯气应用NaOH溶液吸收,其化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O.
(4)新制的氯水滴入AgNO3溶液中,观察到生成白色沉淀现象,原因是氯水中有Cl-.
(5)工业上用氯气和石灰乳反应制漂白粉,漂白粉的有效成分是Ca(ClO)2,漂白粉长时期露至在空气中会失效,用化学方程式表示其失效的原因:Ca(ClO)2+H2O+CO2=CaCO3+2HClO,2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑.
分析 (1)Na的密度比水的密度小,比煤油密度大,在煤油中可隔绝空气与水,钠与水反应生成NaOH和氢气;
(2)过氧化钠为淡黄色固体,与二氧化碳反应生成氧气,可作供氧剂;
(3)氯气与NaOH反应生成氯化钠、次氯酸钠和水,用于氯气的尾气处理;
(4)氯水中含氯离子,与硝酸银反应生成白色沉淀;
(5)用氯气和石灰乳反应制漂白粉,有效成分为次氯酸钙,在空气中会失效,是因先与水、二氧化碳反应生成HClO,后HClO分解而失效.
解答 解:(1)金属钠的密度比水小,实验室中金属钠通常保存在煤油中,一小块金属钠投入水中的反应方程式是2Na+2H2O=2NaOH+H2↑,
故答案为:小;煤油;2Na+2H2O=2NaOH+H2↑;
(2)Na2O2是淡黄色的固体,Na2O2的重要用途是做呼吸面具的供氧剂,有关反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2,
故答案为:淡黄;做呼吸面具的供氧剂;2Na2O2+2CO2=2Na2CO3+O2;
(3)多余的氯气应用NaOH溶液吸收,其化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O,故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;
(4)新制的氯水滴入AgNO3溶液中,观察到生成白色沉淀,原因是氯水中有Cl-,故答案为:生成白色沉淀;氯水中有Cl-;
(5)工业上用氯气和石灰乳反应制漂白粉,漂白粉的有效成分是Ca(ClO)2,漂白粉长时期露至在空气中会失效,用化学方程式表示其失效的原因:Ca(ClO)2+H2O+CO2=CaCO3+2HClO、2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑,
故答案为:Ca(ClO)2;Ca(ClO)2+H2O+CO2=CaCO3+2HClO;2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑.
点评 本题考查综合元素化合物知识,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,注重基础知识的夯实,题目难度不大.

 一线名师提优试卷系列答案
一线名师提优试卷系列答案| A. | 沸腾炉 | B. | 接触室 | C. | 高炉 | D. | 吸收塔 |
 )是一种重要的化工原料和医药中间体,实验室合成三苯甲醇其合成流程如图1所示,装置如图2所示.
)是一种重要的化工原料和医药中间体,实验室合成三苯甲醇其合成流程如图1所示,装置如图2所示.已知:(I)格氏试剂容易水解,
 ;
;
(Ⅱ)相关物质的物理性质如下:
| 物质 | 熔点 | 沸点 | 溶解性 |
| 三苯甲醇 | 164.2℃ | 380℃ | 不溶于水,溶于乙醇、乙醚等有机溶剂 |
| 乙醚 | -116.3℃ | 34.6℃ | 微溶于水,溶于乙醇、笨等有机溶剂 |
| 溴苯 | -30.7℃ | 156.2℃ | 不溶于水,溶于乙醇、乙醚等多数有机溶剂 |
| 苯甲酸已酯 | -34.6℃ | 212.6℃ | 不溶于水 |
| Mg(OH)Br | 常温下为固体 | 能溶于水,不溶于醇、醚等有机溶剂 | |
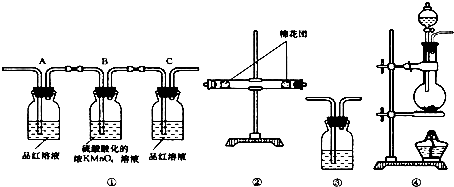
(1)图2中玻璃仪器B的名称:冷凝管;装有无水CaCl2的仪器A的作用是防止空气中的水蒸气进入装置,避免格氏试剂水解;
(2)图2中滴加液体未用普通分液漏斗而用滴液漏斗的作用是平衡压强,使漏斗内液体顺利滴下;制取格氏试剂时要保持微沸,可以采用水浴(方式)加热,优点是受热均匀,温度易于控制;
(3)制得的三苯甲醇粗产品中,含有乙醚、溴苯、苯甲酸乙酯等有机物和碱式溴化镁等杂质,可以设计如下 提纯方案,请填写如下空白:

其中,①操作为蒸馏;洗涤液最好选用:A(从选项中选);A、水 B、乙醚 C、乙醇 D、苯
检验产品已经洗涤干净的操作为:取少量最后一次洗涤液于试管中,滴加硝酸银溶液,若无沉淀生成,则已洗涤干净,反之则未洗涤干净
(4)纯度测定:称取2.60g产品,配成乙醚溶液,加入足量金属钠(乙醚与钠不会反应),充分反应后,测得生成气体体积为100.80m L(标准状况).产品中三苯甲醇质量分数为90%(保留两位有效数字.
| 实验步骤 | 1将一小块金属钠放入滴有酚酞溶液的冷水中 2将一小段用砂纸打磨后的镁带,放入试管中,加入少量水,加热至水沸腾,再向试管中滴加酚酞溶液 3将一小段镁带投入稀盐酸中 4将一小片铝投入稀盐酸中. |
| 实验现象 | A剧烈反应,迅速生成大量的气体 B浮在水面上,熔成小球,不断游动,小球渐小最终消失,溶液变红 C反应不剧烈,产生无色气体 D有气体产生,溶液变成红色 |
| 实验步骤 | 1 | 2 | 3 | 4 |
| 实验现象 |
(3)实验结论金属性强弱顺序是Na>Mg>Al.
(4)请补充该小组同学用原子结构理论解释的上述实验结论:
同周期元素从左至右原子的电子层数相同,核电荷数逐渐增多,原子半径逐渐减小,原子核对电子的引力逐渐增强,失电子能力逐渐减弱,非金属性(填“金属性”或“非金属性”)逐渐减弱.
①需要加热才能发生的反应一定是吸热反应
②放热反应在常温下一定很容易发生
③一个化学反应是放热反应还是吸热反应,决定于反应物和生成物所具有的总能量的相对大小
④化学键的断裂和形成是物质在化学反应中发生能量变化的主要原因.
| A. | ①④ | B. | ①② | C. | ②③ | D. | ③④ |
| A. | MgBr2 | B. | Na2S | C. | KI | D. | KCl |