题目内容
20.用18mol•L-1的浓H2SO4配制100mL浓度为1.8mol•L-1的H2SO4,其操作可分为以下各步:a.用量筒量取10.0ml浓H2SO4缓缓注入装有约50mL蒸馏水的烧杯中,并用玻璃棒不断搅拌
b.用约30mL蒸馏水,洗涤烧杯和玻璃棒三次,将每次洗涤液都倒入容量瓶里
c.将稀释后H2SO4冷却到室温后小心转移入容量瓶里
d.检查100mL容量瓶口部是否会发生滴漏
e.将蒸馏水直接加入容量瓶,至液面接近环形刻度线1-2cm处
f.盖紧瓶塞,反复颠倒振荡,摇匀溶液
g.用胶头滴管向容量瓶里逐滴滴入蒸馏水,至液面最低点恰好和环形刻度线相切
填写下列的空白
(1)步骤C中玻璃棒的作用是引流步骤g中空白处所用仪器名称为胶头滴管
(2)正确的操作顺序是(字母填写)dacbegf
(3)经计算,需浓H2SO4的体积为10mL
(4)①该实验中应选择下列那种规格的容量瓶:B
A.150mL B.100mL C.250mL
②容量瓶所不具备的功能有BCD(填序号 多选).
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.用来加热溶解固体溶质
(5)误差分析,对所配溶液浓度的影响(填偏大,偏小或无影响)
①定容时,俯视刻度线:偏大
②摇匀后液面低于刻度线后又加水:偏小
③配制前,容量瓶壁上有少量水:无影响
④未洗涤烧杯和玻璃棒:偏小
(6)取用任意体积的所配1.8mol•L-1的H2SO4溶液时,下列物理量中不随所取体积的多少而变化的是(填字母 多选)B、D;
A.溶液中H2SO4的物质的量
B.溶液的浓度
C.溶液中H+的数目
D.溶液的密度
(7)写出下列反应的离子方程式:
A.向NaHCO3溶液中滴加盐酸HCO3-+H+=H2O+CO2↑
B.向氨水中滴加AlCl3溶液Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
分析 (1)容量瓶瓶颈较细,转移液体应用玻璃棒引流;定容时,接近刻度线1-2cm应改为胶头滴管逐滴滴加蒸馏水到凹液面最低处与刻度线相切;
(2)依据配制一定物质的量浓度溶液的一般步骤排序;
(3)根据溶液稀释前后物质的量不变计算所需浓硫酸的体积;
(4)①依据配制溶液的体积选择合适的容量瓶;
②依据容量瓶的使用注意事项解答:容量瓶不能稀释浓溶液、不能用于溶解固体、储存溶液,不能用于加热、只能用来配制一定体积准确浓度的溶液;
(5)分析不当操作对溶质的物质的量和溶液的体积的影响,依据C=$\frac{n}{V}$进行误差分析;
(6)根据各物理量的多少与体积是否有关判断;
(7)A.碳酸氢钠与盐酸反应生成氯化钠、二氧化碳和水;
B.向氨水中滴加AlCl3溶液反应生成氢氧化铝和氯化铵.
解答 解:(1)容量瓶瓶颈较细,转移液体应用玻璃棒引流;定容时,接近刻度线1-2cm应改为胶头滴管逐滴滴加蒸馏水到凹液面最低处与刻度线相切;
故答案为:引流;胶头滴管;
(2)配制一定物质的量浓度溶液的操作步骤有检查容量瓶是否漏水、量取、稀释、移液、洗涤、定容、摇匀等操作,所以正确的操作步骤为:d a c b e g f;
故答案为:d a c b e g f;
(3)溶液稀释前后物质的量不变,设需要浓硫酸的体积V,则18mol•L-1×V=1.8mol•L-1×100mL,V=10.0mL,故答案为:10;
(4)①要配制100mL浓度为1.8mol•L-1的H2SO4,应选择100mL容量瓶,故答案为:B;
②容量瓶不能稀释浓溶液、不能用于溶解固体、储存溶液,不能用于加热、只能用来配制一定体积准确浓度的溶液,故选BCD;
(5)①定容时,俯视刻度线,导致溶液的体积偏小,溶液的浓度偏大;
故答案为:偏大;
②摇匀后液面低于刻度线后又加水,导致溶液的体积偏大,溶液的浓度偏小;
故答案为:偏小;
③配制前,容量瓶壁上有少量水,对溶质的物质的量和溶液的体积都不会产生影响,溶液的浓度不变;
故答案为:无影响;
④未洗涤烧杯和玻璃棒,导致溶质的物质的量偏小,溶液的浓度偏小;
故答案为:偏小;
(6)A.溶液中H2SO4的物质的量n=CV,所以与溶液的体积有关,故A错误;
B.溶液具有均一性,浓度与体积无关,故B正确;
C.溶液中H+的数目N=CVNA,所以与溶液的体积有关,故C错误;
D.溶液的密度与所量取溶液的体积无关,故D正确;
故选:BD;
(7)A.碳酸氢钠与盐酸反应生成氯化钠、二氧化碳和水,离子方程式:HCO3-+H+=H2O+CO2↑,故答案为:HCO3-+H+=H2O+CO2↑;
B.向氨水中滴加AlCl3溶液反应生成氢氧化铝和氯化铵,离子方程式:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故答案为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
点评 本题考查了配制一定物质的量浓度溶液、溶液的性质、离子方程式的书写,熟悉配制原理和操作步骤是解题关键,题目难度不大.

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案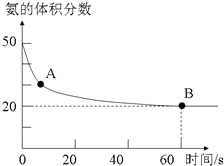 氨气是一种重要的化工原料,在工农业中都有广泛的应用.
氨气是一种重要的化工原料,在工农业中都有广泛的应用.(1)NH3和CO2在120℃和催化剂的作用下可以合成尿素,反应方程式如下:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g).某实验小组向一个容积不变的真空密闭容器中充入CO2与NH3合成尿素.在恒定温度下,混合气体中NH3的含量随时间的变化关系如图所示(该条件下尿素为固体).A点的正反应速率v正(CO2)大于B点的逆反应速率v逆(CO2)(填“大于”、“小于”或“等于”),NH3的平衡转化率为75%.
(2)氨基甲酸铵(NH2COONH4)是合成尿素过程中的中间产物.现将体积比为2:1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生反应并达到平衡:2NH3(g)+CO2(g)?NH2COONH4(s).实验测得在不同温度下的平衡数据如下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度 (10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
②若从已达平衡状态的上述容器中分离出少量的氨基甲酸铵晶体,反应物的转化率将不变(填“增大”、“减小”或“不变”).
(3)向含a mol NH4NO3的溶液中滴加b L氨水后溶液恰好呈中性,则滴加氨水的过程中水的电离平衡将
逆向(填“正向”、“不”或“逆向”)移动,所滴加氨水的浓度为$\frac{a}{200b}$mol•L-1(25℃时,NH3•H2O的电离平衡常数Kb=2×10-5)
| A. | MnO4-、Fe2+、K+、Cl- | B. | Ca2+、Na+、Cl-、SO42- | ||
| C. | Ca2+、Cl-、NO3-、K+ | D. | Ca2+、H+、OH-、CO32- |
| A. | 3n | B. | 3n-8 | C. | -3n | D. | 8-3n |
| A. | 浓硫酸的稀释 | B. | 铝热反应 | ||
| C. | 氢气还原氧化铜 | D. | 氢氧化钡晶体与氯化铵晶体混合 |
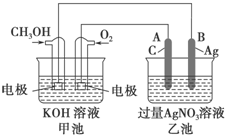 如图是一个化学过程的示意图.已知甲池的总反应式为2CH3OH+3O2+4KOH═2K2CO3+6H2O
如图是一个化学过程的示意图.已知甲池的总反应式为2CH3OH+3O2+4KOH═2K2CO3+6H2O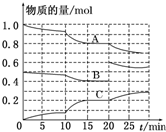 在恒定温度T℃,2L恒容密闭容器中发生反应aA(g)+bB(g)?cC(g),容器中A、B、C物质的量变化如图所示,回答下列问题:
在恒定温度T℃,2L恒容密闭容器中发生反应aA(g)+bB(g)?cC(g),容器中A、B、C物质的量变化如图所示,回答下列问题: