题目内容
【题目】碳酸锰是制造电信器材软磁铁氧体,合成二氧化锰和制造其他锰盐的原料。工业上用软锰矿(主要成分是MnO2·MnO,含有少量Fe2O3、Al2O3、SiO2)制备碳酸锰的流程如下:
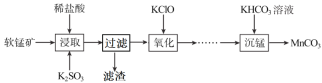
(1)“浸取”步骤中,MnO2·MnO发生反应的离子方程式为___,还能被K2SO3还原的物质有___(填化学式)。“过滤”时滤渣的主要成分是___。
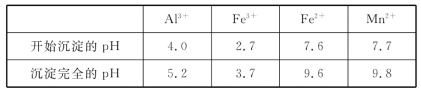
(2)如表列出了几种离子生成氢氧化物沉淀的pH(“沉淀完全”是指溶液离子浓度低于1.0×10-5mol·L-1),请补充完整由“氧化”后的溶液制备MnCO3的实验方案:向“氧化”后的溶液中加入____,调pH为___,___,得较纯MnCl2溶液,加入KHCO3溶液沉锰得MnCO3。(实验中可能用到的试剂为K2CO3溶液、盐酸)。
(3)“沉锰”步骤的离子方程式为___,若Mn2+沉淀完全时测得溶液中CO32-的浓度为2.2×10-6mol·L-1,则Ksp(MnCO3)=___。
(4)实验室可以用Na2S2O8溶液来检验Mn2+是否完全发生反应,原理为:Mn2++S2O82-+H2O---H++SO42-+MnO4-
①请配平上述离子方程式___;
②确认Mn2+离子已经完全反应的现象是___。
【答案】MnO2·MnO+SO32-+4H+=2Mn2++SO42-+2H2O Fe2O3 SiO2 K2CO3 [5.2,7.7)(或5.2≦pH<7.7 过滤 Mn2++2HCO3-=MnCO3↓+CO2↑+H2O 2.2×10-11 2Mn2++5S2O82-+8H2O=16H++10SO42-+2MnO4- 取少量待测试样于试管中,滴入Na2S2O8溶液,溶液不变为紫色
【解析】
(1)“浸取”步骤中,MnO2·MnO与稀盐酸和K2SO3发生反应,其离子方程式为MnO2·MnO+SO32-+4H+=2Mn2++SO42-+2H2O。
答案为:MnO2·MnO+SO32-+4H+=2Mn2++SO42-+2H2O;
Fe3+具有较强的氧化性,能将K2SO3氧化,所以还能被K2SO3还原的物质有Fe2O3。
答案为:Fe2O3;
“过滤”时滤渣的主要成分是SiO2。答案为:SiO2;
(2)因为反应所得的锰盐溶液中混有Fe3+和Al3+,所以需要调节溶液的pH,让二种离子完全沉淀,但不能让Mn2+生成沉淀,然后过滤,洗涤。
由“氧化”后的溶液制备MnCO3的实验方案:向“氧化”后的溶液中加入K2CO3。
答案为:K2CO3;
调pH为[5.2,7.7)(或5.2≦pH<7.7。答案为:[5.2,7.7)(或5.2≦pH<7.7
过滤。答案为:过滤;
得较纯MnCl2溶液,加入KHCO3溶液沉锰得MnCO3。(实验中可能用到的试剂为K2CO3溶液、盐酸)。
(3)“沉锰”步骤的离子方程式为Mn2++2HCO3-=MnCO3↓+CO2↑+H2O。
答案为:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O;
若Mn2+沉淀完全时测得溶液中CO32-的浓度为2.2×10-6mol·L-1,则Ksp(MnCO3)=
![]() 。答案为:2.2×10-11;
。答案为:2.2×10-11;
(4)①利用得失电子守恒,配平上述离子方程式
2Mn2++5S2O82-+8H2O=16H++10SO42-+2MnO4-。
答案为:2Mn2++5S2O82-+8H2O=16H++10SO42-+2MnO4-;
②确认Mn2+离子已经完全反应的现象是取少量待测试样于试管中,滴入Na2S2O8溶液,溶液不变为紫色。
答案为:取少量待测试样于试管中,滴入Na2S2O8溶液,溶液不变为紫色。