题目内容
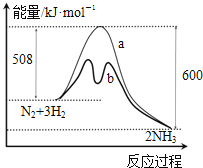
【题目】用氟硼酸(HBF4,属于强酸)代替硫酸做铅蓄电池的电解质溶液,可使铅蓄电池在低温下工作时的性能更优良,反应方程式为:Pb+PbO2+4HBF4![]() 2Pb(BF4)2+2H2O;Pb(BF4)2为可溶于水的强电解质,下列说法正确的是
2Pb(BF4)2+2H2O;Pb(BF4)2为可溶于水的强电解质,下列说法正确的是
A.充电时,当阳极质量减少23.9g时转移0.2 mol电子
B.放电时,PbO2电极附近溶液的pH增大
C.电子放电时,负极反应为PbO2+4HBF4-2e-=Pb(BF4)2+2HF4-+2H2O
D.充电时,Pb电极的电极反应式为PbO2+H++2e-=Pb2++2H2O
【答案】B
【解析】
A.充电时阳极发生反应Pb2++2H2O-2e-=PbO2+4H+,产生1molPbO2,转移2mol电子,阳极增重1mol×239g/mol=239g,若阳极质量增加23.9g时转移0.2mol电子,A错误;
B.放电时正极上发生还原反应,PbO2+4H++2e-=Pb2++2H2O,c(H+)减小,所以溶液的pH增大,B正确;
C.放电时,负极上是金属Pb失电子,发生氧化反应,不是PbO2发生失电子的氧化反应,C错误;
D.充电时,PbO2电极与电源的正极相连,作阳极,发生氧化反应,电极反应式为Pb2++2H2O-2e-=PbO2+4H+,Pb电极与电源的负极相连,D错误;
故合理选项是B。

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案【题目】下表列出了①~⑨九种元素在周期表中的位置。
族 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
请按要求回答下列问题:
(1)①~⑨九种元素中非金属性最强的是________(填元素符号)。
(2)元素⑧的原子结构示意图是_________;由①、④、⑥三种元素组成的化合物,其电子式是_________。
(3)元素②、⑧的气态氢化物的稳定性较强的是________________(填化学式);元素③、⑨的最高价氧化物对应的水化物的酸性较强的是________________(填化学式)。
(4)③、④span>、⑧三种元素的原子半径由大到小的顺序是________________(填元素符号)。
(5)元素⑤、⑥组成的化合物的化学键类型是________________________。
(6)元素⑥的最高价氧化物对应的水化物与元素⑦的最高价氧化物对应的水化物反应的离子方程式是________________
【题目】某学习小组研究溶液中Fe2+的稳定性,进行如下实验,观察,记录结果。

实验Ⅰ
物质 | 0 min | 1min | 1h | 5h |
FeSO4 | 淡黄色 | 桔红色 | 红色 | 深红色 |
(NH4)2Fe(SO4)2 | 几乎无色 | 淡黄色 | 黄色 | 桔红色 |
(1)上述(NH4)2Fe(SO4)2溶液pH小于FeSO4的原因是_______(用化学用语表示)。溶液的稳定性:FeSO4_______(NH4)2Fe(SO4)2(填“>”或“<”) 。
(2)甲同学提出实验Ⅰ中两溶液的稳定性差异可能是(NH4)2Fe(SO4)2溶液中的NH4+保护了Fe2+,因为NH4+具有还原性。进行实验Ⅱ,否定了该观点,补全该实验。
操作 | 现象 |
取_______,加_______,观察。 | 与实验Ⅰ中(NH4)2Fe(SO4)2溶液现象相同。 |
(3)乙同学提出实验Ⅰ中两溶液的稳定性差异是溶液酸性不同导致,进行实验Ⅲ:分别配制0.80 mol·L-1 pH为1、2、3、4的FeSO4溶液,观察,发现pH=1的FeSO4溶液长时间无明显变化,pH越大,FeSO4溶液变黄的时间越短。
资料显示:亚铁盐溶液中存在反应 4Fe2++O2+10H2O ![]() 4Fe(OH)3+8H+
4Fe(OH)3+8H+
由实验III,乙同学可得出的结论是_______,原因是_______。
(4)进一步研究在水溶液中Fe2+的氧化机理。测定同浓度FeSO4溶液在不同pH条件下,Fe2+的氧化速率与时间的关系如图(实验过程中溶液温度几乎无变化)。反应初期,氧化速率都逐渐增大的原因可能是_____。

(5)综合以上实验,增强Fe2+稳定性的措施有_______。
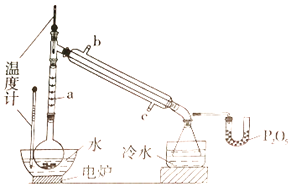
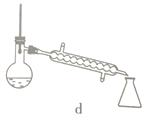
【题目】硼酸三甲酯用作柠檬类水果的熏蒸剂。实验室合成硼酸三甲酯的原理及装置如下:
硼酸三甲酯 | 甲醇 | |
溶解性 | 与乙醚、甲醇混溶,能水解 | 与水混溶 |
沸点/℃ | 68 | 64 |
硼酸三甲酯与甲醇混合物的共沸点为54℃ | ||
Na2B4O7·10H2O+2H2SO4+16CH3OH![]() 2NaHSO4+4[(CH3O)3B+CH3OH]+17H2O
2NaHSO4+4[(CH3O)3B+CH3OH]+17H2O
实验步骤如下:
①在圆底烧瓶中加入44.8g甲醇和19.1gNa2B4O7·10H2O (硼砂,式量为382),然后缓慢加入浓H2SO4并振荡;加热烧瓶中的液体;通过分馏柱回流一段时间。
②先接收51~55℃的馏分,再接收55~60℃的馏分。
③将两次馏分合并,加入氯化钙进行盐析分层,上层为硼酸三甲酯,分离。
④精馏得高纯硼酸三甲酯19.2g。
回答下列问题:
(1)图中仪器a的名称为____________;直形冷凝管冷却水应从____________(填“b”或“c”)接口进入。
(2)本实验加热方式为____________,优点是____________。
(3)加入氯化钙盐析分层的主要目的是____________。
(4)U型管中P2O5的作用是_____________________________________。
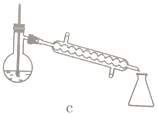
(5)步骤④的仪器选择及安装都正确的是____________ (填标号),应收集____________℃的馏分。


(6)本次实验的产率是____________。