题目内容
【题目】(1)写出氯原子的原子结构示意图____________,NH4Cl的电子式_______________;
(2)用电子式表示H2O的形成过程_________________________________________________;
(3)已知一定条件下,白磷转化为红磷释放出能量,则等质量的白磷比红磷具有的能量___(填“高”、“低”),故白磷比红磷稳定性_____(填“强”、“弱”),等质量的白磷和红磷充分燃烧均生成五氧化二磷,______放出热量多。
(4)在“绿色化学工艺”中,理想状态是反应物中的原子全部转化为欲制得的产物,即原子利用率为100%。下列反应类型能体现“原子经济性”原则的是 ____。(请填序号)
①置换反应,②化合反应, ③分解反应, ④取代反应, ⑤加成反应,⑥加聚反应
(5)电解法冶炼金属铝的化学方程式为_____________。取等物质的量的MgO和Fe2O3 的混合物进行铝热反应,反应的化学方程式为________________,引发铝热反应的实验操作是__________。
【答案】 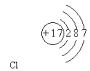
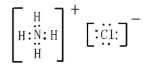
![]() 高 弱 白磷 ②⑤⑥ 2Al2O3(熔融)
高 弱 白磷 ②⑤⑥ 2Al2O3(熔融)![]() 4Al+3O2↑ Fe2O3+2Al
4Al+3O2↑ Fe2O3+2Al ![]() 2Fe+Al2O3 加少量KClO3 , 插上镁条并将其点燃
2Fe+Al2O3 加少量KClO3 , 插上镁条并将其点燃
【解析】(1)氯原子的核电荷数=核外电子总数=17,最外层为7个电子;氯化铵属于离子化合物,铵根离子和氯离子都需要标出所带电荷及最外层电子;
(2)水分子为共价化合物,其分子中存在两个氧氢键,据此写出用电子式表示H2O的形成过程;
(3)放热反应中,反应物总能量大于生成物总能量,则白磷能量高;物质的能量越高,该物质越不稳定;生成物相同时,反应物总能量越高,则反应中放热热量越高;
(4)根据“绿色化学工艺”的特征:反应物中原子全部转化为欲制得的产物,即原子的利用率为100%;即生成物质只有一种,由原子守恒推测反应物的种类;
(5)工业上电解熔融氧化铝冶炼铝;氧化铁和铝在高温下发生铝热反应生成氧化铝和铁,为使反应顺利进行,可加入氯酸钾,为助燃剂,点燃镁时反应可发生,镁为引燃剂。
(1)氯原子的原子序数为17,其原子核外有3个电子层,各层容纳电子数分别为2、8、7,氯原子结构示意图为:![]() ;
;
氯化铵为离子化合物,阴阳离子都需要标出所带电荷及最外层电子,氯化铵的电子式为: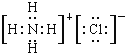 ,
,
故答案为:![]() ;
;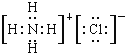 ;
;
(2)氢原子和氧原子之间以共用电子对而形成水分子,用电子式表示形成过程为:![]() ,
,
故答案为:![]() ;
;
(3)已知一定条件下,白磷转化为红磷释放出能量,说明反应物能量大于生成物总能量,则等质量的白磷比红磷具有的能量高,能量越高的物质越不稳定,故白磷比红磷稳定性弱;等质量的白磷和红磷充分燃烧均生成五氧化二磷,由于白磷能量高,属于白磷放出热量多,
故答案为:高;弱;白磷.
(4)“原子经济性”原则的是反应物中的原子全部转化为欲制得的产物,即原子利用率为100%;题中反应符合的是化合反应;加成反应;加聚反应。
故答案为:②⑤⑥。
(5)电解法冶炼金属铝的化学方程式为2Al2O3(熔融)![]() 4Al+3O2↑ ;氧化铁和铝在高温下发生铝热反应生成氧化铝和铁,反应的化学方程式为Fe2O3+2Al
4Al+3O2↑ ;氧化铁和铝在高温下发生铝热反应生成氧化铝和铁,反应的化学方程式为Fe2O3+2Al ![]() 2Fe+Al2O3,为使反应顺利进行,可加入氯酸钾,为助燃剂,点燃镁时反应可发生,镁为引燃剂,所以引发铝热反应的实验操作是加少量KClO3 , 插上镁条并将其点燃,
2Fe+Al2O3,为使反应顺利进行,可加入氯酸钾,为助燃剂,点燃镁时反应可发生,镁为引燃剂,所以引发铝热反应的实验操作是加少量KClO3 , 插上镁条并将其点燃,
因此,本题正确答案是:2Al2O3(熔融)![]() 4Al+3O2↑ ;Fe2O3+2Al
4Al+3O2↑ ;Fe2O3+2Al ![]() 2Fe+Al2O3;加少量KClO3 , 插上镁条并将其点燃。
2Fe+Al2O3;加少量KClO3 , 插上镁条并将其点燃。