题目内容
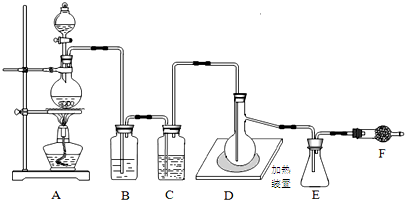
11.下列装置是从废溴化铝催化剂中制取单质溴并回收氯化铝实验的部分装置,不能达到实验目的是( )| A. |  用图所示装置氧化Br- | |
| B. |  用图所示装置萃取Br2 | |
| C. |  用图所示装置分离CCl4和Br2 | |
| D. |  用图所示的装置将含AlCl3的溶液蒸发制取无水AlCl3 |
分析 A.氯气的氧化性大于溴单质,氯气可以将溴离子氧化成溴单质;
B.溴易溶于有机溶剂四氯化碳、微溶于水,可用萃取方法分离出溴;
C.溴易溶于四氯化碳,需要通过蒸馏操作分离四氯化碳和溴;
D.铝离子水解生成氢氧化铝和氯化氢,蒸发过程中铝离子水解程度增大,而氯化氢易挥发,最终得到的是氢氧化铝,无法获得氯化铝固体.
解答 解:A.Cl2具有强氧化性,可以氧化Br-生成Br2,故A正确;
B.Br2易溶于有机物,可以用CCl4萃取分离出来,故正确;
C.Br2溶于CCl4中,可用蒸馏法分离,故C正确;
D.在蒸发时,会促进Al3+水解,生成的HCl会挥发,最终得到Al(OH)3,无法获得无水氯化铝,故D错误;
故选D.
点评 本题考查了化学实验装置的综合应用,题目难度中等,明确常见装置特点及化学基本操作方法为解答关键,D为易错点,注意铝离子的水解及氯化氢的挥发性.

练习册系列答案
相关题目
14.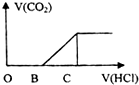 向某NaOH溶液中通入CO2气体后 得到溶液M,因CO2通入的量不同,溶液M的组成也不同,若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如图所示.则下列分析与判断正确的是(不计CO2溶解)( )
向某NaOH溶液中通入CO2气体后 得到溶液M,因CO2通入的量不同,溶液M的组成也不同,若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如图所示.则下列分析与判断正确的是(不计CO2溶解)( )
 向某NaOH溶液中通入CO2气体后 得到溶液M,因CO2通入的量不同,溶液M的组成也不同,若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如图所示.则下列分析与判断正确的是(不计CO2溶解)( )
向某NaOH溶液中通入CO2气体后 得到溶液M,因CO2通入的量不同,溶液M的组成也不同,若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如图所示.则下列分析与判断正确的是(不计CO2溶解)( )| A. | 若OB=0,则溶液M为Na2CO3溶液 | |
| B. | 若OB=BC,则形成溶液M所发生反应的离子方程式为OH-+CO2═HCO3- | |
| C. | 若3OB=BC,则溶液M中c(NaHCO3)=2c(Na2CO3) | |
| D. | 若OB>BC,则溶液M中大量存在的阴离子为CO32-和HCO3- |
19.几种短周期元素的原子半径及常见化合价见表:
请分析上表中有关数据,并结合已学知识,回答以下问题(涉及上述元素的答案,请用元素符号表示):
(1)E元素在周期表中位置是第二周期IA族.
(2)A、H、J对应离子的半径由大到小的顺序是F->Na+>Al3+(填离子符号)
(3)A与J所形成的化合物中含有离子键(填“离子”或“共价”)
(4)写出DB2的电子式: .
.
(5)写出D的最高价氧化物与J的最高价氧化物对应水化物X的溶液(足量)发生反应的离子方程式:CO2+OH-=HCO3-.
| 元素代号 | A | B | C | D | E | F | G | H | I | J | K |
| 常见化合价 | -1 | -2 | +5、-3 | +4、-4 | +6、+4、-2 | +4、-4 | +5、-3 | +3 | +2 | +1 | +1 |
| 原子半径/pm | 71 | 74 | 75 | 77 | 102 | 117 | 110 | 143 | 160 | 186 | 152 |
(1)E元素在周期表中位置是第二周期IA族.
(2)A、H、J对应离子的半径由大到小的顺序是F->Na+>Al3+(填离子符号)
(3)A与J所形成的化合物中含有离子键(填“离子”或“共价”)
(4)写出DB2的电子式:
 .
.(5)写出D的最高价氧化物与J的最高价氧化物对应水化物X的溶液(足量)发生反应的离子方程式:CO2+OH-=HCO3-.
16.用金属铜制取硝酸铜,从节约原料和防止环境污染考虑,最好的方法是( )
| A. | Cu $\stackrel{浓硝酸}{→}$ Cu(NO3)2 | B. | Cu$\stackrel{AgNO_{3}}{→}$ Cu(NO3)2 | ||
| C. | Cu $\stackrel{Cl_{2}}{→}$ CuCl2$\stackrel{稀硝酸}{→}$Cu(NO3)2 | D. | Cu$\stackrel{空气}{→}$ CuO $\stackrel{HNO_{3}}{→}$ Cu(NO3)2 |
3.科学家冶炼出了纯度高达99.9999%的铁,你估计它不会具有的性质是( )
| A. | 在潮湿的空气中放置不易生锈 | B. | 硬度比生铁大 | ||
| C. | 与2mol/L盐酸的反应生成氢气 | D. | 在冷的浓H2SO4溶液中可钝化 |
20.某羧酸酯的分子式为C18H26O5,1mol该酯完全水解可得到1mol羧酸和2mol乙醇,该羧酸的分子式为( )
| A. | C14H18O5 | B. | C14H16O4 | C. | C14H22O5 | D. | C14H10O5 |
1.下列解释事实的离子方程式不正确的是( )
| A. | Na放入水中,产生气体:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | FeCl3溶液刻蚀印刷线路板:2Fe3++Cu═2Fe2++Cu2+ | |
| C. | 铜溶于酸化的H2O2溶液:Cu+2H++H2O2═Cu2++2H2O | |
| D. | Al片与少量NaOH溶液反应,产生气体:2Al+2OH-+2H2O═2Al(OH)3+3H2↑ |

 )和双氧水为原料生产过氧化苯甲酰,写出合成过氧化苯甲酰的化学反应方程式:
)和双氧水为原料生产过氧化苯甲酰,写出合成过氧化苯甲酰的化学反应方程式: ;
;
 ,属于酚类结构的同分异构体有3种.
,属于酚类结构的同分异构体有3种.