题目内容
19.图1表示的化合物I的名称为甲基环氧乙烷,化合物I常用于制备药物和合成高分子材料.(1)化合物I的分子式为C3H6O.
(2)化合物I在催化剂作用下能与发生水反应得到二元醇,该反应的化学方程式为
 +H2O→
+H2O→ .
.(3)慢心律是一种治疗心律失常的药物,它的合成路线如图2:

①III→IV的反应类型为加成反应;III的结构简式为
 .
.②写出化合物III与浓溴水反应的化学方程式
 +3Br2→
+3Br2→ ↓+3HBr.
↓+3HBr.③由III制备IV的过程中有少量副产物V生成,V与IV互为同分异构体.V的结构简式为
 .
.(4)化合物IV还可用于制备高分子化合物VII,涉及的过程为:Ⅳ$\stackrel{浓H_{2}SO_{4}/△}{→}$Ⅵ$→_{加聚反应}^{催化剂}$Ⅶ.已知VI的分子中不含甲基,写出反应VI→VII的化学方程式
 .
.
分析 (1)根据Ⅰ的结构简式可写出分子式;
(2)Ⅰ与水发生加成反应生成乙二醇;
(3)物质Ⅱ在碱性条件下水解、再酸化得物质Ⅲ为 ,Ⅲ与Ⅰ发生加成反应生成Ⅳ,由于Ⅰ有不对称三元环,在加成过程中断裂碳氧双键有两种方法,所以可以得到两种产物,除了Ⅳ外还有一种Ⅴ为
,Ⅲ与Ⅰ发生加成反应生成Ⅳ,由于Ⅰ有不对称三元环,在加成过程中断裂碳氧双键有两种方法,所以可以得到两种产物,除了Ⅳ外还有一种Ⅴ为 ;
;
(4)IV在浓硫酸作催化剂、加热条件下发生反应生成VI,VI的分子中不含甲基,则VI的结构简式为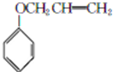 ,VI在催化剂条件下发生加聚反应生成VII,则VII为
,VI在催化剂条件下发生加聚反应生成VII,则VII为 .
.
解答 解:(1)根据Ⅰ的结构简式可知分子式为C3H6O,故答案为:C3H6O;
(2)Ⅰ与水发生加成反应生成乙二醇为 +H2O→
+H2O→ ,故答案为:
,故答案为: +H2O→
+H2O→ ;
;
(3)物质Ⅱ在碱性条件下水解、再酸化得物质Ⅲ为 ,Ⅲ与Ⅰ发生加成反应生成Ⅳ,由于Ⅰ有不对称三元环,在加成过程中断裂碳氧双键有两种方法,所以可以得到两种产物,除了Ⅳ外还有一种Ⅴ为
,Ⅲ与Ⅰ发生加成反应生成Ⅳ,由于Ⅰ有不对称三元环,在加成过程中断裂碳氧双键有两种方法,所以可以得到两种产物,除了Ⅳ外还有一种Ⅴ为 ,
,
①Ⅲ+Ⅰ→Ⅳ的反应类型为 加成反应,Ⅲ的结构简式为 ,故答案为:加成反应;
,故答案为:加成反应; ;
;
②化合物Ⅲ与浓溴水反应的化学方程式为 +3Br2→
+3Br2→ ↓+3HBr,故答案为:
↓+3HBr,故答案为: +3Br2→
+3Br2→ ↓+3HBr;
↓+3HBr;
③V的结构简式为 ,故答案为:
,故答案为: ;
;
(4)IV在浓硫酸作催化剂、加热条件下发生反应生成VI,VI的分子中不含甲基,则VI的结构简式为 ,VI在催化剂条件下发生加聚反应生成VII,则VII为
,VI在催化剂条件下发生加聚反应生成VII,则VII为 ,则VI生成VII的反应方程式为
,则VI生成VII的反应方程式为 ,
,
故答案为: .
.
点评 本题考查有机物结构和性质及有机物推断,侧重考查学生分析判断能力,明确官能团及其性质关系是解本题关键,结合反应条件、部分物质结构简式进行推断,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案
相关题目
10.高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂.已知反应Fe2O3+K2O${\;}_{{\;}_{2}}$→K2FeO4+K2O(未配平),下列说法正确的是( )
| A. | K2O2既是氧化剂又是还原剂 | |
| B. | K2FeO4的氧化性强于K2O2 | |
| C. | 16gFe2O3发生反应,有0.3mole-转移 | |
| D. | 用K2FeO4处理水时有Fe(OH)3胶体生成 |
7.在实验室中,对下列事故或药品的处理正确的是( )
| A. | 有大量的氯气泄漏时,用肥皂水浸湿软布蒙面,并迅速离开现场 | |
| B. | 金属钠着火燃烧时,用泡沫灭火器灭火 | |
| C. | NaCl必须保存在棕色瓶中 | |
| D. | 含硫酸的废液倒入水槽,用水冲入下水道 |
14.常温下,下列溶液中的微粒浓度关系正确的是( )
| A. | 氯气通入NaOH溶液:c(Na+)=c(Cl-)+c(ClO-)+c(H+) | |
| B. | NaHCO3溶液:c(Na+)>c(HCO3-)+c(CO32-)+c(H2CO3) | |
| C. | 0.2mol•L-1CH3COOH溶液与0.1mol•L-1NaOH溶液等体积混合:c(CH3COO-)+c(CH3COOH)=0.1mol•L-1 | |
| D. | PH=11的氨水与PH=3的硫酸等体积混合:c(SO42-)=2c(NH4+)>c(OH-)>c(H+) |
4.常温下,下列盐的水溶液pH<7的是( )
| A. | Na2CO3 | B. | Na2S | C. | FeCl3 | D. | NaCl |
11.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 0.1 mol•L-1Mg(NO3)2溶液中含有0.2 NA个NO3- | |
| B. | 标准状况下,11.2LH2O含有的分子数为0.5NA | |
| C. | 3mol Cu和足量稀硝酸反应产生2 NA个NO分子 | |
| D. | 1 mol Cl2与足量NaOH溶液反应,转移电子数为NA |
8.用NA表示阿伏伽德罗常数的值.下列叙述正确的是( )
| A. | 98g H2SO4和H3PO4中含有的氧原子数均为4NA | |
| B. | 电解食盐水若产生2g氢气,则转移的电子数目为NA | |
| C. | 33.6L NO2溶解于足量的水中得到硝酸溶液,溶液中NO3-数目为NA | |
| D. | 2L 0.5mol•L-1硫酸钾溶液中阴离子所带电荷数为NA |
9.有Xn-、Yn+、Z三种粒子,其电子层结构相同.下列分析正确的是( )
| A. | 粒子半径大小的关系是Xn-<Yn+ | B. | Z一定是稀有气体元素 | ||
| C. | 原子序数关系是:Z>Y>X | D. | 原子半径关系是:X>Y |