题目内容
8.用NA表示阿伏伽德罗常数的值.下列叙述正确的是( )| A. | 98g H2SO4和H3PO4中含有的氧原子数均为4NA | |
| B. | 电解食盐水若产生2g氢气,则转移的电子数目为NA | |
| C. | 33.6L NO2溶解于足量的水中得到硝酸溶液,溶液中NO3-数目为NA | |
| D. | 2L 0.5mol•L-1硫酸钾溶液中阴离子所带电荷数为NA |
分析 A.磷酸与硫酸的摩尔质量都是98g/mol,且二者分子式中都含有4个氧原子;
B.依据电解饱和食盐水电解反应和电子守恒计算分析;
C.气体的状况未知,Vm不确定;
D.1mol硫酸钾中含有1mol硫酸根离子,带有2mol负电荷.
解答 解:A.98g H2SO4和H3PO4的物质 的量为1mol,1mol硫酸和1mol磷酸都含有4mol氧原子,所以98g H2SO4和H3PO4中含有的氧原子数均为4NA,故A正确;
B.电解食盐水若产生2g氢气,电解反应为2H++2e-=H2↑,则转移的电子数目为2NA,故B错误;
C.气体的状况未知,Vm不确定,不能使用Vm=22.4L/mol,故C错误;
D.2L 0.5mol•L-1硫酸钾溶液中含有阴离子1mol,所带电荷数为2NA,故D错误;
故选:A.
点评 本题考查阿伏加德罗常数的有关计算和判断,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系是解题关键,注意气体摩尔体积的使用条件,题目难度不大.

练习册系列答案
相关题目
18.用NA表示阿伏伽德罗常数的值.下列叙述正确的是( )
| A. | 在标准状况下,1mol水的体积是22.4L | |
| B. | 在标准状况下,22.4L氦气所含的原子数约为2NA | |
| C. | 同温同压下,等体积的硫酸和硝酸所含氢原子数之比为2:1 | |
| D. | 1molCxHy分子中所含C-H数目为yNA |
16.实验室保存下列试剂的方法有错误的是( )
| A. | 新制氯气盛放在棕色试剂瓶中,存放于低温避光的地方 | |
| B. | 固体碘常盛放在棕色细口瓶中 | |
| C. | 液溴易挥发,盛放在用水液封的棕色试剂瓶中 | |
| D. | 金属钠易被氧化,少量金属钠应储存在煤油中 |
3.NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 常温下18g 铝放入足量浓硫酸中转移电子数2NA | |
| B. | 0.1mol•L-1的稀硫酸中含有H+个数为0.2NA | |
| C. | 常温常压下48g的O3中含有氧原子数为3NA | |
| D. | 1.8g NH4+中含有的电子数为0.1NA |
20.下列叙述中正确的是( )
| A. | 一定温度下,向AgCl的饱和溶液中加入NaCl晶体,Ksp(AgCl)增大 | |
| B. | NH4Cl溶液中存在:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| C. | 向CH3COOH溶液中加入少量CH3COONa固体,溶液pH增大 | |
| D. | 某温度下,KW=1×10-12,则pH=11的氨水中,c(OH-)=1×10-8mol/L |
17.在恒温、体积为2L的密闭容器中进行反应:2A(g)?3B(g)+C(g),若反应物在前20s由3mol将为1.8mol,则前20s的平均反应速率为( )
| A. | v(B)=0.03mol•L-1•s-1 | B. | v(B)=0.045mol•L-1•s-1 | ||
| C. | v(C)=0.03mol•L-1•s-1 | D. | v(C)=0.06mol•L-1•s-1 |
18.下列说法正确的是( )
| A. | 软脂酸和油酸互为同系物 | |
| B. | 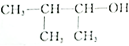 的命名为:3-甲基-2-丁醇 的命名为:3-甲基-2-丁醇 | |
| C. | 苯酚能与溴水反应,苯不能与溴水反应,说明羟基对苯环有影响 | |
| D. | 与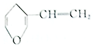 互为同分异构体的芳香族化合物有4种 互为同分异构体的芳香族化合物有4种 |
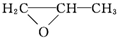 +H2O→
+H2O→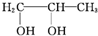 .
.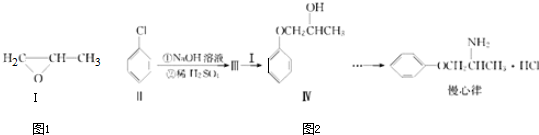
 .
.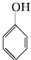 +3Br2→
+3Br2→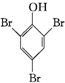 ↓+3HBr.
↓+3HBr.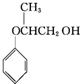 .
. .
.