题目内容
15.在200C时,100g水中溶解mgNa2CO3即达到饱和状态;100g水中溶解ngNa2CO3•10H2O也达到饱和状态,则m与n的关系是( )| A. | m>n | B. | m=n | C. | m<n | D. | 无法判断 |
分析 该温度下饱和碳酸钠溶液中,溶质的质量分数一定相等;计算出ngNa2CO3•10H2O中含有的碳酸钠的质量,然后根据ω=$\frac{{m}_{溶质}}{{m}_{溶液}}$列出等式,然后整理可以得出m与n的关系.
解答 解:因为温度不变,所以两种情况所得的饱和溶液质量分数相等,
ngNa2CO3•10H2O 中Na2CO3的质量为:ng×$\frac{106}{106+180}$=$\frac{106n}{286}$g,
根据溶液的质量分数相等可得:$\frac{m}{100+m}$=$\frac{\frac{106n}{286}}{100+n}$,
整理得:m=$\frac{1060n}{2860+18n}$<n,
故选C.
点评 本题考查了饱和溶液特点、溶质质量分数的计算,题目难度不大,注意掌握饱和溶液的概念及特点,明确溶质质量分数的表达式为解答本题的关键.

练习册系列答案
相关题目
3.相同条件下,将1体积的CO和2体积的CO2混合,混合气体中碳、氧原子个数之比为( )
| A. | 1:1 | B. | 1:2 | C. | 2:1 | D. | 3:5 |
10.将少量的金属钠投入到过量的AlCl3溶液中,产生的现象是( )
| A. | 只有气体产生 | B. | 生成白色沉淀 | ||
| C. | 生成无色透明溶液 | D. | 产生气体和白色沉淀 |
7.现有铁和铜组成的合金共a mol,其中铜的物质的量分数为x.将此合金研成粉末状后全部投入含bmolHNO3的稀溶液中,微热使其充分反应,HNO3还原产物只得到NO.
(1)用粒子符号填写下列空白(列举出全部可能出现的情况).
(2)当溶液中金属离子只有Fe2+、Cu2+时,则b的取值范围是(用a,x表示)$\frac{8a(1-x)}{3}$<b≤$\frac{8a}{3}$.
(3)当x=0.5,溶液中Fe3+和Fe2+的物质的量相等时,在标准状况下共产生672mlNO气体.求a和b的值a=0.04mol,b=0.12mol.
(1)用粒子符号填写下列空白(列举出全部可能出现的情况).
| 组序 成分 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 残留固体成分 | ||||||
| 溶液中的金属离子 |
(3)当x=0.5,溶液中Fe3+和Fe2+的物质的量相等时,在标准状况下共产生672mlNO气体.求a和b的值a=0.04mol,b=0.12mol.
4.氧化还原反应的实质是( )
| A. | 反应中原子重新组合 | B. | 得氧,失氧 | ||
| C. | 化合价升降 | D. | 电子转移 |
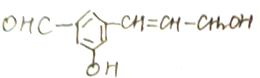 在下列反应中生成的有机物的结构简式.
在下列反应中生成的有机物的结构简式.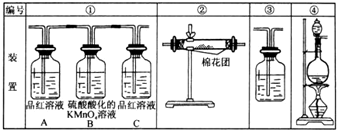 (1)浓硫酸与木炭粉在加热条件下反应的化学方程式是:C+2H2SO4(浓)=CO2↑+2SO2↑+2H2O
(1)浓硫酸与木炭粉在加热条件下反应的化学方程式是:C+2H2SO4(浓)=CO2↑+2SO2↑+2H2O