题目内容
12.下列与硫酸型酸雨的形成无关的是( )| A. | 工业上大量含硫燃料的燃烧 | B. | 工业生产使空气中CO2含量增加 | ||
| C. | SO2在尘埃催化下氧化为SO3 | D. | SO3与水反应生成H2SO4 |
分析 当雨水的pH<5.6时称为酸雨,硫酸型“酸雨”的形成过程可近似地看成是:途经一:排放到空气中的二氧化硫与潮湿空气中的氧气和水蒸气,在空气中粉尘的催化下化合生成硫酸;途径二:是空气中的二氧化硫气体在粉尘做催化剂的条件下生成三氧化硫,三氧化硫再与雨水形成酸雨,据此分析解答.
解答 解:A.工业上大量燃烧含硫燃料如煤、石油等,产生二氧化硫等气体,空气中的SO2可与雨水反应,发生SO2+H2O?H2SO3,H2SO3进一步被氧气氧化生成H2SO4,2H2SO3+O2=2H2SO4,硫酸溶在雨水中,使雨水呈酸性,形成酸雨;所以工业上大量含硫燃料的燃烧是硫酸型酸雨形成的主要原因,故A正确;
B.空气中CO2的含量升高,会加剧温室效应,与硫酸型酸雨形成无关,故B错误;
C.空气中的二氧化硫气体在粉尘做催化剂的条件下2SO2+O2$\frac{\underline{\;粉尘\;}}{\;}$2SO3生成三氧化硫,三氧化硫再与雨水反应SO3+H2O=H2SO4形成酸雨,故C正确;
D.三氧化硫与雨水反应SO3+H2O=H2SO4形成酸雨,故D正确;
故选B.
点评 本题考查了酸雨形成的过程分析,掌握硫酸型酸雨的空气污染物是二氧化硫是解答关键,题目难度不大.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案
相关题目
3.相同条件下,将1体积的CO和2体积的CO2混合,混合气体中碳、氧原子个数之比为( )
| A. | 1:1 | B. | 1:2 | C. | 2:1 | D. | 3:5 |
7.现有铁和铜组成的合金共a mol,其中铜的物质的量分数为x.将此合金研成粉末状后全部投入含bmolHNO3的稀溶液中,微热使其充分反应,HNO3还原产物只得到NO.
(1)用粒子符号填写下列空白(列举出全部可能出现的情况).
(2)当溶液中金属离子只有Fe2+、Cu2+时,则b的取值范围是(用a,x表示)$\frac{8a(1-x)}{3}$<b≤$\frac{8a}{3}$.
(3)当x=0.5,溶液中Fe3+和Fe2+的物质的量相等时,在标准状况下共产生672mlNO气体.求a和b的值a=0.04mol,b=0.12mol.
(1)用粒子符号填写下列空白(列举出全部可能出现的情况).
| 组序 成分 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 残留固体成分 | ||||||
| 溶液中的金属离子 |
(3)当x=0.5,溶液中Fe3+和Fe2+的物质的量相等时,在标准状况下共产生672mlNO气体.求a和b的值a=0.04mol,b=0.12mol.
4.氧化还原反应的实质是( )
| A. | 反应中原子重新组合 | B. | 得氧,失氧 | ||
| C. | 化合价升降 | D. | 电子转移 |
2.高分子分离膜可以让某些物质有选择地通过而将物质分离,下列应用不属于高分子分离膜应用范围的是( )
| A. | 分离工业废水,回收废液中的有用成分 | |
| B. | 将化学能转换成电能,将热能转换成电能 | |
| C. | 食品工业中,浓缩天然果汁、乳制品加工和酿酒 | |
| D. | 海水淡化 |

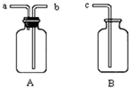 如图所示用一起A、B和胶管组成装置收集NO气体(仪器A已经气密性检查;除水外不能选用其他试剂)正确的操作步骤是:在A中加满水,盖紧瓶塞,用胶管连接b和c接口,由a导入NO气体,水通过b和c排入B中.
如图所示用一起A、B和胶管组成装置收集NO气体(仪器A已经气密性检查;除水外不能选用其他试剂)正确的操作步骤是:在A中加满水,盖紧瓶塞,用胶管连接b和c接口,由a导入NO气体,水通过b和c排入B中.