题目内容
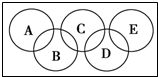
16.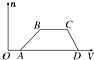 某混合溶液中可能含有HCl、MgCl2、AlCl3、NH4Cl、Na2CO3、KCl中的几种物质,往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入的NaOH溶液体积(V)的关系如图所示.回答下列问题.
某混合溶液中可能含有HCl、MgCl2、AlCl3、NH4Cl、Na2CO3、KCl中的几种物质,往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入的NaOH溶液体积(V)的关系如图所示.回答下列问题.(1)溶液中一定含有的溶质是HCl、AlCl3、NH4Cl(填化学式).
(2)溶液中一定不含有的溶质是Na2CO3、MgCl2(填化学式).
(3)溶液中可能含有的溶质是氯化钾(填名称).
(4)分别写出AB段、BC段发生反应的离子方程式:
①AB段为Al3++3OH-=Al(OH)3↓;②BC段为NH4++OH-=NH3•H2O.
分析 根据图象可知,OA段无沉淀,说明有HCl,则无Na2CO3;
AB段有沉淀,CD段沉淀完全消失,说明沉淀为Al(OH)3,说明溶液中只有AlCl3,无MgCl2;
BC段沉淀不变,说明溶液中含有NH4Cl,此段铵根离子与氢氧根离子反应,
根据分析可知,溶液中一定含有HCl、AlCl3、NH4Cl,一定不含Na2CO3、MgCl2,可能含有KCl,据此进行解答.
解答 解:根据图象可知,OA段无沉淀,说明有HCl,则无Na2CO3;
AB段有沉淀,CD段沉淀完全消失,说明沉淀为Al(OH)3,说明溶液中只有AlCl3,无MgCl2;
BC段沉淀不变,说明溶液中含有NH4Cl,此段铵根离子与氢氧根离子反应,
根据分析可知,溶液中一定含有HCl、AlCl3、NH4Cl,一定不含Na2CO3、MgCl2,可能含有KCl,
CD段,沉淀消失,说明在AB段只有Al(OH)3↓,无Mg(OH)2↓,所以溶液中只有AlCl3,无MgCl2,
(1)溶液中一定含有HCl、AlCl3、NH4Cl,
故答案为:HCl、AlCl3、NH4Cl;
(2)溶液中一定不含Na2CO3、MgCl2,
故答案为:Na2CO3、MgCl2;
(3)溶液中可能存在的物质为氯化钾,
故答案为:氯化钾;
(4)①AB段铝离子与氢氧根离子反应生成氢氧化铝沉淀,反应的离子方程式为:Al3++3OH-=Al(OH)3↓,
故答案为:Al3++3OH-=Al(OH)3↓;
②BC段铵根离子与氢氧根离子结合生成一水合氨,反应的离子方程式为:NH4++OH-=NH3•H2O,
故答案为:NH4++OH-=NH3•H2O.
点评 本题考查了未知物的推断,题目难度中等,明确图象中曲线变化的含义为解答关键,试题侧重考查学生的分析、理解能力,注意掌握常见物质的性质及检验方法,明确铝离子与氢氧根离子反应的现象,为解答该题的突破口.

 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案(1)用粒子符号填写下列空白(列举出全部可能出现的情况).
| 组序 成分 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 残留固体成分 | ||||||
| 溶液中的金属离子 |
(3)当x=0.5,溶液中Fe3+和Fe2+的物质的量相等时,在标准状况下共产生672mlNO气体.求a和b的值a=0.04mol,b=0.12mol.
| A. | 反应中原子重新组合 | B. | 得氧,失氧 | ||
| C. | 化合价升降 | D. | 电子转移 |
| A. | 若金属有剩余,在溶液中再滴入硫酸后,金属又开始溶解 | |
| B. | 若金属全部溶解,则溶液中一定含有Fe3+ | |
| C. | 若硝酸有剩余,溶液中可能含有Fe2+ | |
| D. | 若金属全部溶解,且产生336mL气体(标准状况下),则b=0.3 |
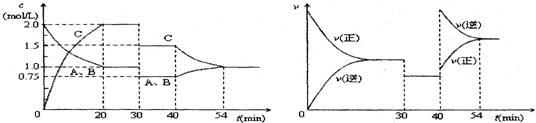
| A. | 30min时减小容积 | |
| B. | 40min时加入催化剂 | |
| C. | 0~20min内A的平均反应速率为0.05mol•L-1•min-1 | |
| D. | 正反应为吸热反应 |
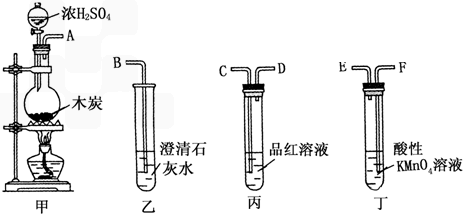
 (1)浓硫酸与木炭粉在加热条件下反应的化学方程式是:C+2H2SO4(浓)=CO2↑+2SO2↑+2H2O
(1)浓硫酸与木炭粉在加热条件下反应的化学方程式是:C+2H2SO4(浓)=CO2↑+2SO2↑+2H2O
 焰色反应是化学上用来测定某种金属是否存在于化合物的方法.
焰色反应是化学上用来测定某种金属是否存在于化合物的方法. ,C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2.根据以上信息回答下列问题:
,C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2.根据以上信息回答下列问题: