题目内容
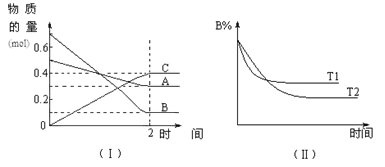
【题目】将一定量NO2和N2O4的混合气体通入体积为1 L的恒温密闭容器中,各物质浓度随时间变化的关系如图所示:

计算该反应的平衡常数K=________。反应进行到20 min时,再向容器内充入一定量NO2,10 min后达到新的平衡,此时测得c(NO2)=0.9 mol·L-1。第一次平衡时混合气体中NO2的体积分数为w1,达到新平衡后混合气体中NO2的体积分数为w2,则w1________w2(填“>”、“=”或“<”)。
【答案】0.9 >
【解析】
根据图像可知平衡时![]() ,代入
,代入 计算;反应进行到20min时,再向容器内充入一定量
计算;反应进行到20min时,再向容器内充入一定量![]() ,等效为在原平衡基础上增大压强,平衡向生成
,等效为在原平衡基础上增大压强,平衡向生成![]() 的方向移动,平衡时
的方向移动,平衡时![]() 的体积分数减小。
的体积分数减小。
根据![]() 2
2![]() 结合图像可知X曲线表示NO2,Y曲线表示N2O4,则平衡时
结合图像可知X曲线表示NO2,Y曲线表示N2O4,则平衡时![]() ,则平衡常数
,则平衡常数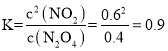 ;恒温恒容下,再充入一定量
;恒温恒容下,再充入一定量![]() ,等效为增大压强,平衡逆向移动,新平衡后混合气体中
,等效为增大压强,平衡逆向移动,新平衡后混合气体中![]() 的体积分数减小,故w1>w2。
的体积分数减小,故w1>w2。

 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案【题目】为了提高煤的利用率,人们先把煤转化为CO和H2,再将它们转化为甲醇,某实验人员在一定温度下2L的密闭容器中,充入一定量的H2和CO,发生反应:2H2(g)+CO(g)![]() CH3OH(g),测定的部分实验数据如下:
CH3OH(g),测定的部分实验数据如下:
t/s | 0 | 500 | 1000 |
c(H2)/ mol.L-1 | 5.00 | 3.52 | 2.48 |
c(CO)/ mol.L-1 | 2.50 |
(1)在500s内用H2表示的化学反应速率是________________。
(2)在1000s内用CO表示的化学反应速率是________________,1000s时CO的转化率是________。
(3)在500s时生成的甲醇的浓度是________
【题目】已知A(g)+B(g)![]() C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的ΔH______0(填“<”“>”或“=”)。
(2)830 ℃时,向一个5 L的密闭容器中充入0.20 mol的A和0.80 mol的B,如反应初始6 s内A的平均反应速率v(A)=0.003 mol·L-1·s-1,则6 s时c(A)=________mol·L-1,C的物质的量为________mol;若反应经一段时间后,达到平衡时A的转化率为________,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为________。
(3)1200℃时反应C(g)+D(g)![]() A(g)+B(g)的平衡常数的值为________。
A(g)+B(g)的平衡常数的值为________。