题目内容
【题目】近年来,随着人类社会的快速发展,环境污染日益严重,而环境污染中的很多问题是由于氮磷富集化引起的,所以如何降低水体中的氮磷含量问题受到广泛关注。目前有两种较为有效的氨氮废水处理方法。
I.化学沉淀法
利用了Mg2+与PO43-与氨氮生成MgNH4PO46H2O沉淀以达到去除氨氮的效果。
已知:磷在pH=8-10时主要存在形式为HPO42-
Ksp(MgNH4PO46H2O)=2.5×10-13
(1)请写出pH=8时,化学沉淀法去除NH4+的离子方程式为_。
(2)氨氮去除率与含磷微粒浓度随pH变化如图1所示,已知:Ksp[Mg3(PO4)2]=6.3×10-26,请解释pH>10时氨氮去除率随pH变化的原因:__。

II.光催化法
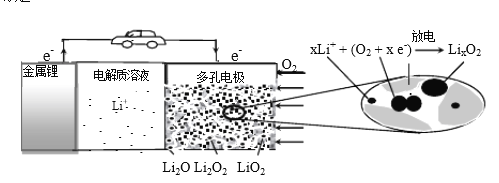
(3)光催化降解过程中形成的羟基自由基(·OH)和超氧离子(·O2-)具有光催化能力,催化原理如图2所示。请写出NO3-转化为无毒物质的电极反应式:__。

(4)经过上述反应后,仍有NH4+残留,探究其去除条件。
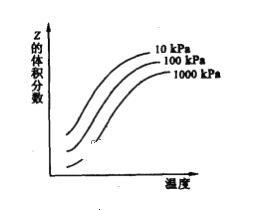
①温度对氨氮去除率影响如图3所示。温度升高,氨氮去除率变化的可能原因是:__;__(请写出两条)。

②选取TiO2作为催化剂,已知:TiO2在酸性条件下带正电,碱性条件下带负电。请在图4中画出pH=5时,氨氮去除率变化曲线_____。

(5)为测定处理后废水中(含少量游离酸)残留NH4+浓度,可选用甲醛-滴定法进行测定。取20mL的处理后水样,以酚酞为指示剂,用0.0100mol/LNaOH滴定至酚酞变红,此时溶液中游离酸被完全消耗,记下消耗NaOH的体积V1mL;然后另取同样体积水样,加入甲醛,再加入2-3滴酚酞指示剂,静置5min,发生反应:6HCHO+4NH4+=(CH2)6N4H++6H2O+3H+,继续用NaOH滴定,发生反应:(CH2)6N4H++OH-=(CH2)6N4+H2O;H++OH-=H2O。滴定至终点,记录消耗NaOH的体积V2mL,水样中残留NH4+浓度为__mol/L。
【答案】Mg2++HPO42-+NH4++6H2O=MgNH4PO46H2O↓+H+ pH>10时NH4+与OH-反应生成NH3而挥发,Mg2+与PO43-反应生成Mg3(PO4)2沉淀,使氨氮去除率降低 2NO3-+12H++6e-=N2↑+6H2O 温度升高羟基自由基(·OH)和超氧离子(·O2-)的运动速率加快,羟基自由基(·OH)和超氧离子(·O2-)活性增大 温度升高羟基自由基(·OH)和超氧离子(·O2-)的形成速率增大,温度升高反应速率加快 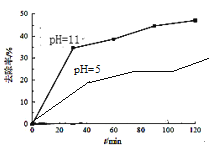
![]()
【解析】
(1)pH=8时,磷主要以HPO42-的形式存在,则应为Mg2+、HPO42-、NH4+发生反应,生成MgNH4PO46H2O沉淀。
(2) pH>10时,磷主要以PO43-的形式存在,从Ksp[Mg3(PO4)2]=6.3×10-26看,易生成Mg3(PO4)2沉淀,氨氮去除率降低,则表明NH4+与碱发生了反应。
(3)从图中可以看出,NO3-在H+存在的环境中得电子,生成N2等。
(4)①温度升高,氨氮去除率变化的可能原因是从温度对羟基自由基(·OH)和超氧离子(·O2-)的影响进行分析。
②依信息:TiO2在酸性条件下带正电,碱性条件下带负电。则在pH=5时,TiO2带正电,吸引NH4+的能力差,氨氮去除率比pH=11时要小。
(5)依题意,溶液中剩余的H++OH-=H2O,4NH4+——(CH2)6N4H++3H+——4OH-
代入数据即可求出水样中残留NH4+浓度。
(1)pH=8时,磷主要以HPO42-的形式存在,则应为Mg2+、HPO42-、NH4+发生反应,生成MgNH4PO46H2O沉淀,则反应的离子方程式为Mg2++HPO42-+NH4++6H2O=MgNH4PO46H2O↓+H+。答案为:Mg2++HPO42-+NH4++6H2O=MgNH4PO46H2O↓+H+;
(2) pH>10时,磷主要以PO43-的形式存在,由Ksp[Mg3(PO4)2]=6.3×10-26可知,此时PO43-易生成Mg3(PO4)2沉淀,从而使氨氮去除率降低,此时应发生NH4+与OH-的反应。从而得出pH>10时氨氮去除率随pH变化的原因是pH>10时NH4+与OH-反应生成NH3而挥发,Mg2+与PO43-反应生成Mg3(PO4)2沉淀,使氨氮去除率降低。答案为:pH>10时NH4+与OH-反应生成NH3而挥发,Mg2+与PO43-反应生成Mg3(PO4)2沉淀,使氨氮去除率降低;
(3)从图中可以看出,NO3-在H+存在的环境中得电子,生成N2等,电极反应式为2NO3-+12H++6e-=N2↑+6H2O。答案为:2NO3-+12H++6e-=N2↑+6H2O;
(4)①温度升高,氨氮去除率变化的可能原因是温度升高羟基自由基(·OH)和超氧离子(·O2-)的运动速率加快,羟基自由基(·OH)和超氧离子(·O2-)活性增大;温度升高羟基自由基(·OH)和超氧离子(·O2-)的形成速率增大,温度升高反应速率加快。答案为:温度升高羟基自由基(·OH)和超氧离子(·O2-)的运动速率加快,羟基自由基(·OH)和超氧离子(·O2-)活性增大;温度升高羟基自由基(·OH)和超氧离子(·O2-)的形成速率增大,温度升高反应速率加快;
②依信息:TiO2在酸性条件下带正电,碱性条件下带负电。则在pH=5时,TiO2带正电,吸引NH4+的能力差,氨氮去除率比pH=11时要小。则pH=5时,氨氮去除率变化曲线为:
 答案为:
答案为: ;
;
(5)依题意,溶液中剩余的H++OH-=H2O,4NH4+——(CH2)6N4H++3H+——4OH-
则n(NH4+)=0.01mol/L×V2×10-3L-0.01mol/L×V1×10-3L=0.01(V2-V1)×10-3mol,
水样中残留NH4+浓度为![]() =
=![]() mol/L。答案为:
mol/L。答案为:![]() ;
;

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案