题目内容
【题目】(I)下表是25℃时某些弱酸的电离平衡常数。
化学式 | CH3COOH | HClO | H2CO3 | H2C2O4 |
Ka | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 | Ka1=5.9×10-2 Ka2=6.4×10-5 |
(1)H2C2O4与含等物质的量的KOH的溶液反应后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为__。
(2)pH相同的NaClO和CH3COOK溶液,其溶液的物质的量浓度的大小关系是(填“>”、“<”或“=”):CH3COOK_____NaClO,两溶液中:[c(Na+)-c(ClO-)]_____[c(K+)-c(CH3COO-)]。
(3)碳酸钠溶液中滴加少量氯水的离子方程式为__________。
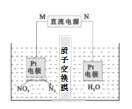
(II)H3PO2也可用电渗析法制备。“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):

(4)写出阳极的电极反应式_________。
(5)分析产品室可得到H3PO2的原因___________。
【答案】c(K+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-) > = 2CO32-+Cl2+H2O═Cl-+ClO-+2HCO3- 2H2O-4e-=O2↑+4H+ 阳极室的H+穿过阳膜扩散至产品室,原料室的H2PO2-穿过阴膜扩散至产品室,二者反应生成H3PO2
【解析】
(I)(1)二者恰好完全反应生成KHC2O4,混合溶液呈酸性,说明HC2O4-电离程度大于水解程度,但是其电离和水解程度都较小;
(2)酸的电离平衡常数越大,其对应的酸根离子水解程度越小,则pH相同的钠盐或钾盐,弱离子水解程度越大其盐溶液浓度越小;
两种溶液的pH相等,则两种溶液中c(H+)、c(OH-)分别相等,[c(Na+)-c(ClO-)]=c(OH-)-c(H+)、[c(K+)-c(CH3COO-)]=c(OH-)-c(H+);
(3)酸的电离平衡常数越大,该酸的酸性越强,强酸能和弱酸盐反应生成弱酸,由于酸性:H2CO3>HClO>HCO3-,所以碳酸钠溶液中滴入少量氯水,二者反应生成NaClO、NaCl和NaHCO3;
II.(4)在阳极上水失电子生成氧气和氢离子;
(5)阳极生成氧气和氢离子,氢离子通过阳离子交换膜进入产品室,阴极上生成氢气和氢氧根离子,原料室中阳离子通过交换膜进入阴极室,原料室中阴离子通过交换膜进入产品室。
I.(1)二者恰好完全反应生成KHC2O4,KHC2O4发生电离:KHC2O4=K++HC2O4-,混合溶液呈酸性,说明HC2O4-电离程度大于水解程度,但是其电离和水解程度都较小,水还电离出氢离子,所以c(H+)>c(C2O42-),溶液中氢氧根离子浓度很小,所以存在c(H+)>c(C2O42-)>c(OH-),则溶液中存在c(K+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-);
(2)酸的电离平衡常数越大,其对应的酸根离子水解程度越小,则pH相同的NaClO和CH3COOK,弱离子水解程度越大其盐溶液浓度越小,电离平衡常数:CH3COOH>HClO,水解程度:NaClO>CH3COOK,所以溶液浓度:c(CH3COOK)>c(NaClO);
[c(Na+)-c(ClO-)]=c(OH-)-c(H+)、[c(K+)-c(CH3COO-)]=c(OH-)-c(H+),两种溶液的pH相等,则两种溶液中c(H+)、c(OH-)分别相等,则[c(Na+)-c(ClO-)]=[c(K+)-c(CH3COO-)]=c(OH-)-c(H+);
(3)酸的电离平衡常数越大,酸的酸性越强,强酸能和弱酸盐反应生成弱酸,酸性:H2CO3>HClO>HCO3-,所以二者反应生成NaClO、NaCl和NaHCO3,二者反应的离子方程式为2CO32-+Cl2+H2O═Cl-+ClO-+2HCO3-;
II.(4)阳极上水失电子生成氧气和氢离子,所以阳极的电极反应式为2H2O-4e-=O2↑+4H+;
(5)在阳极H2O失去电子生成O2和H+,H+通过阳离子交换膜进入产品室,阴极上生成H2和OH-,原料室中阳离子通过交换膜进入阴极室,原料室中阴离子H2PO2-通过交换膜进入产品室,H+与H2PO2-反应产生H3PO2。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】双氧水(过氧化氢)常用于消毒、杀菌、漂白等。某化学兴趣小组同学,围绕着过氧化氢开展了调査研究与实验。
I.调查
(1)过氧化氢常用于消毒、杀菌、漂白等方面的主要原因是________。
(2)制备过氧化氢目前最常用的是乙基蒽醌法,其主要过程可以用如图表示,此过程中总反应式为________。

Ⅱ.不稳定性实验研究
(3)为了探究温度、催化剂等外界条件对 H2O2的分解速率的影响,某兴趣小组同学设计了如下三组实验,部分实验数据已经填在下面表中。
实验编号 | T/X | H2O2初始浓度/mol·L-1 | FeCl3初始浓度/mol·L-1 |
I | 20 | 1.0 | _______ |
II | 50 | 1.0 | 0 |
III | 50 | ___________ | 0.1 |
实验I、Ⅱ研究______对分解速率的影响,实验Ⅱ、Ⅲ研究催化剂对分解速率的影响,则实验Ⅲ中H2O2初始浓度应为________mol·L-1。
III.过氧化氢含量的实验测定
兴趣小组同学用0.1000mol·L-1酸性高锰酸钾标准溶液滴定试样中过氧化氢的含量,反应原理为2MnO4-+5H2O2+6H+=2Mn2+ +8H2O+5O2↑
(4)用移液管吸取25.00mL试样置于锥形瓶中,重复滴定四次,每次消耗的KMnO4标准溶液体积如下表所示:
第一次 | 第二次 | 第三次 | 第四次 | |
体积(mL) | 17.10 | 18.10 | 18.00 | 17.90 |
计算试样中过氧化氢的浓度为________mol·L-1(保留三位有效数字)。