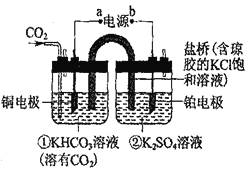
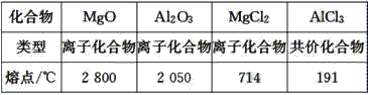
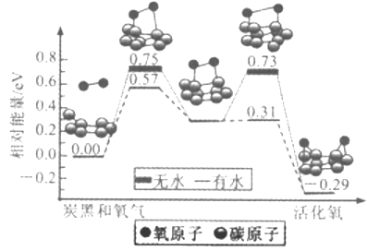
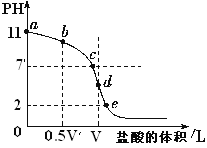
题目内容
【题目】某盐溶液NaHR的电离方程式为NaHR=Na++HR-下列有关说法不正确的是
A.Na2R溶液的pH值一定大于7
B.若NaHR溶液中c( OH-)>c( R2-)则溶液呈碱性
C.c(Na+)>c(HR-)>c( R2-)>c(OH-)>c( H+)
D.NaHR溶液的pH值不一定大于7
【答案】C
【解析】
A.根据某盐溶液NaHR的电离方程式为NaHR=Na++HR-,可知H2R为二元弱酸,则Na2R在溶液中能水解;
B.HR-在溶液中存在电离平衡和水解平衡,根据二者的程度判断溶液的酸碱性;
C.若c( R2-)>c(OH-),以电离为主,溶液呈酸性;
D.不能确定HR-在溶液中是以电离为主还是水解为主,则不能确定溶液的酸碱性。
A.根据某盐溶液NaHR的电离方程式为NaHR=Na++HR-,可知H2R为二元弱酸,则Na2R在溶液中能水解使溶液显碱性,所以Na2R溶液的pH值一定大于7,A正确;
B.HR-在溶液中存在电离平衡和水解平衡,HR-+H2O![]() OH-+H2R,HR-
OH-+H2R,HR-![]() H++R2-,若NaHR溶液中c(OH-)>c( R2-),则水解程度大于电离程度,所以溶液显碱性,B正确;
H++R2-,若NaHR溶液中c(OH-)>c( R2-),则水解程度大于电离程度,所以溶液显碱性,B正确;
C.HR-在溶液中存在电离平衡和水解平衡:HR-![]() H++R2-,HR-+H2O
H++R2-,HR-+H2O![]() OH-+H2R,若c( R2-)>c(OH-),以电离为主,溶液呈酸性,则c(Na+)>c(HR-)>c( H+)>c( R2-)>c(OH-),错误;
OH-+H2R,若c( R2-)>c(OH-),以电离为主,溶液呈酸性,则c(Na+)>c(HR-)>c( H+)>c( R2-)>c(OH-),错误;
D.HR-在溶液中存在电离平衡和水解平衡:HR-![]() H++R2-,HR-+H2O
H++R2-,HR-+H2O![]() OH-+H2R,若HR-在溶液中是以电离为主,则溶液显酸性,若以水解为主,则溶液显碱性,所以NaHR溶液的pH值不一定大于7,D正确;
OH-+H2R,若HR-在溶液中是以电离为主,则溶液显酸性,若以水解为主,则溶液显碱性,所以NaHR溶液的pH值不一定大于7,D正确;
故合理选项是C。

【题目】(I)下表是25℃时某些弱酸的电离平衡常数。
化学式 | CH3COOH | HClO | H2CO3 | H2C2O4 |
Ka | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 | Ka1=5.9×10-2 Ka2=6.4×10-5 |
(1)H2C2O4与含等物质的量的KOH的溶液反应后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为__。
(2)pH相同的NaClO和CH3COOK溶液,其溶液的物质的量浓度的大小关系是(填“>”、“<”或“=”):CH3COOK_____NaClO,两溶液中:[c(Na+)-c(ClO-)]_____[c(K+)-c(CH3COO-)]。
(3)碳酸钠溶液中滴加少量氯水的离子方程式为__________。
(II)H3PO2也可用电渗析法制备。“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):

(4)写出阳极的电极反应式_________。
(5)分析产品室可得到H3PO2的原因___________。