题目内容
【题目】高锰酸钾是重要的氧化剂。回答下列问题:
(1)实验室常用高锰酸钾制备氧气。
①该反应的还原产物是___(写化学式),每生成1gO2转移___mol电子。
②高锰酸钾完全分解后,将固体生成物溶于水后过滤,向滤液中通入过量的二氧化碳。充分反应后过滤,得到二氧化锰,将滤液再经过重结晶分离,可得到高锰酸钾和碳酸氢钾。写出上述过程发生反应的化学方程式:___。
(2)实验室常用硫酸酸化的草酸(H2C2O4,二元弱酸)溶液滴定KMnO4溶液,测定KMnO4溶液浓度。步骤如下:
I.将-定量的高锰酸钾加入烧杯中,倒入蒸馏水使其溶解;
II.取ag草酸晶体(H2C2O4·2H2O,摩尔质量126g·mol-1)溶于水配成250mL溶液,取25.00mL溶液置于锥形瓶中,加入适量稀H2SO4酸化,再用KMnO4溶液滴定至终点,重复滴定两次,平均消耗VmLKMnO4溶液。
①高锰酸钾溶液盛放在___(填“酸式”或“碱式”)滴定管中。
②滴定到达终点的现象是___。
③该KMnO4溶液的物质的量浓度为___mol·L-1(用相关字母表示)。
【答案】K2MnO4和MnO2 0.125 3K2MnO4+4CO2+2H2O=2KMnO4+ MnO2↓+4KHCO3 酸式 加入最后一滴高锰酸钾溶液,溶液变为浅红色,且半分钟内不褪色 ![]()
【解析】
(1)①高锰酸钾受热分解生成锰酸钾、二氧化锰和氧气,反应方程式为:2KMnO4![]() K2MnO4+ MnO2+ O2↑,根据方程式判断;
K2MnO4+ MnO2+ O2↑,根据方程式判断;
②高锰酸钾完全分解后,将固体生成物溶于水后过滤,滤液为锰酸钾溶液,向滤液中通入过量的二氧化碳,产物为二氧化锰、高锰酸钾和碳酸氢钾;
(2)①高锰酸钾具有强氧化性,能腐蚀橡胶,应盛放在酸式滴定管中;
②高锰酸钾与草酸反应完毕,加入最后一滴高锰酸钾溶液,溶液变为浅红色,且半分钟内不褪色;
③草酸与高锰酸钾反应的离子反应为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O,根据草酸与高锰酸钾的关系进行计算。
(1)①高锰酸钾受热分解生成锰酸钾、二氧化锰和氧气,反应方程式为:2KMnO4![]() K2MnO4+ MnO2+ O2↑,反应中 Mn元素的化合价从+7价降低到+6、+4价,还原产物为K2MnO4和MnO2,生成1mol O2电子转移4mol,因此生成1gO2转移的电子的物质的量为
K2MnO4+ MnO2+ O2↑,反应中 Mn元素的化合价从+7价降低到+6、+4价,还原产物为K2MnO4和MnO2,生成1mol O2电子转移4mol,因此生成1gO2转移的电子的物质的量为![]() mol=0.125mol;
mol=0.125mol;
②高锰酸钾完全分解后,将固体生成物溶于水后过滤,滤液为锰酸钾溶液,向滤液中通入过量的二氧化碳,产物为二氧化锰、高锰酸钾和碳酸氢钾,反应的方程式为:3K2MnO4+4CO2+2H2O=2 KMnO4+ MnO2↓+4KHCO3;
(2)①高锰酸钾具有强氧化性,能腐蚀橡胶,应盛放在酸式滴定管中;
②高锰酸钾与草酸反应完毕,加入最后一滴高锰酸钾溶液,溶液变为浅红色,且半分钟内不褪色即达到滴定终点;
③ag草酸晶体溶于水配成250mL溶液,取出25.00mL溶液,含有溶质![]() =
=![]() mol,根据关系5H2C2O4~2KMnO4可知KMnO4的物质的量为
mol,根据关系5H2C2O4~2KMnO4可知KMnO4的物质的量为![]() ×
×![]() =
=![]() mol,KMnO4溶液的物质的量浓度c=
mol,KMnO4溶液的物质的量浓度c=![]() =
=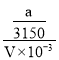 mol/L=
mol/L=![]() mol/L。
mol/L。

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案【题目】今有室温下四种溶液,有关叙述不正确的是
序号 | ① | ② | ③ | ④ |
pH | 11 | 11 | 3 | 3 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A. ③④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B. ②③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C. 分别加水稀释10倍,四种溶液的pH①>②>④>③
D. V1L④与V2L①溶液混合后,若混合后溶液pH=7,则V1<V2
【题目】(I)下表是25℃时某些弱酸的电离平衡常数。
化学式 | CH3COOH | HClO | H2CO3 | H2C2O4 |
Ka | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 | Ka1=5.9×10-2 Ka2=6.4×10-5 |
(1)H2C2O4与含等物质的量的KOH的溶液反应后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为__。
(2)pH相同的NaClO和CH3COOK溶液,其溶液的物质的量浓度的大小关系是(填“>”、“<”或“=”):CH3COOK_____NaClO,两溶液中:[c(Na+)-c(ClO-)]_____[c(K+)-c(CH3COO-)]。
(3)碳酸钠溶液中滴加少量氯水的离子方程式为__________。
(II)H3PO2也可用电渗析法制备。“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):

(4)写出阳极的电极反应式_________。
(5)分析产品室可得到H3PO2的原因___________。