题目内容
查找资料发现,N2制取有下列不同方案:
a方案:加热条件下NH3还原CuO制得纯净的N2和活性铜粉
b方案:加热NaNO2和NH4Cl的浓溶液制得
c方案:将空气缓慢地通过灼热的铜粉制得较纯的N2
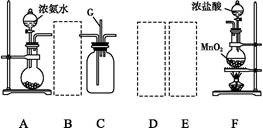
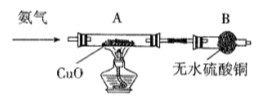
现在实验室有供选择的如下几种仪器来制取N2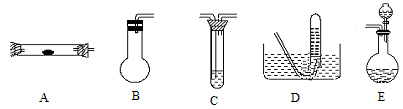
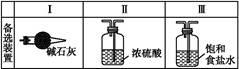
(1)若按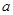 方案制N2时,需要的氨气用生石灰和浓氨水作原料制取,则宜采用上述仪器中的____________(填A、B、C……下同)作NH3的发生器,要制取并收集N2,还须选用到的仪器是___________。
方案制N2时,需要的氨气用生石灰和浓氨水作原料制取,则宜采用上述仪器中的____________(填A、B、C……下同)作NH3的发生器,要制取并收集N2,还须选用到的仪器是___________。
(2)写出b方案中反应的化学方程式_________________________
(3)若按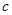 方案制取N2,则氮气中一定混有何种杂质气体 ______________________
方案制取N2,则氮气中一定混有何种杂质气体 ______________________
(4)上述制N2的三个方案中,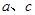 方案结合使用越来越受到人们的关注,这种方法与
方案结合使用越来越受到人们的关注,这种方法与 方案相比,其优越性在于____________。
方案相比,其优越性在于____________。
(1)E AD或者ACD (2)NH4Cl + NaNO2 = N2 ↑+ 2H2O + NaCl
(3)稀有气体(多答CO2不扣分) (4)铜与氧化铜可循环使用,避开有毒的NaNO2
解析试题分析:(1)若按a方案制N2,若需要的氨气用固体生石灰和液态的浓氨水作原料制取,应该采用仪器中的E。(2)加热NaNO2和NH4Cl的浓溶液制得N2的方程式是:NH4Cl + NaNO2 = N2 ↑+ 2H2O + NaCl。
(3)因为空气中含有N2、O2、CO2、惰性气体等。若将空气缓慢地通过灼热的铜粉制取N2,则氮气中一定混有CO2、惰性气体等杂质气体。(4)上述制N2的三个方案中,a、c方案结合使用越来越受到人们的关注,这种方法与b方案相比,其优越性在于铜与氧化铜可循环使用,避开有毒的NaNO2。
考点:考查N2的各种工业制法的比较及化学反应原理的知识。

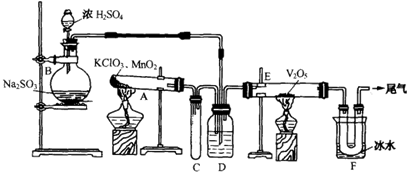
某兴趣小组设计如下图实验装置进行实验。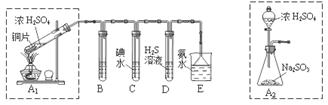
Ⅰ、探究大气污染物SO2的性质
(1)为了实现绿色环保的目标,能否用上图A2代替A1装置 (填“能”或“否”)。
(2)B、C、D分别用于检验SO2的漂白性、还原性和氧化性,则B中所盛试剂为 ,C中反应的离子方程式为 ,D中反应的化学方程式为 。
Ⅱ、探究铜片与浓H2SO4反应的产物
实验结束,发现在铜片表面附着黑色固体。查阅资料得知:此黑色固体可能含有CuO、CuS、Cu2S。常温下CuS和Cu2S都不溶于稀盐酸,在空气中煅烧都转化为Cu2O和SO2。该小组同学收集一定量黑色固体,按如下实验方案探究其成分: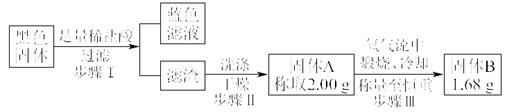
(3)步骤Ⅱ 中检验滤渣洗涤干净的实验方法是_____________________________。
(4)黑色固体的成分是________________。
Ⅲ、尾气处理
用氨水吸收尾气中的SO2,“吸收液”中可能含有OH-、SO32-、SO42-、HSO3-等阴离子。
(5)氨水吸收过量SO2的反应的离子方程式为 。
(6)已知亚硫酸氢盐一般易溶于水,SO2也易溶于水。
现有仪器和试剂为:小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2 mol/L盐酸、
2 mol/LHNO3、1 mol/LBaCl2溶液、l mol/LBa(OH)2溶液、品红溶液、蒸馏水。请设计实验证明“吸收液”中存在SO32-、HSO3-,完成下表的实验操作、预期现象和结论:
| 实验操作 | 预期现象与结论 |
| 步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取l mol/L BaCl2溶液向小烧杯滴加直至过量。 | 若出现白色浑浊,则“吸收液” 中存在SO32-或 SO42-。 |
| 步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体 。 | , 则“吸收液”中存在 SO32-。 |
| 步骤3: 。 | , 则“吸收液”中存在 HSO3-。 |
某化学小组进行Na2SO3的性质实验探究。
(1)在白色点滴板的a、b、c三个凹槽中滴有Na2SO3溶液,再分别滴加下图所示的试剂: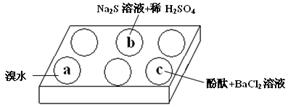
实验现象如下表:
| 编号 | 实验现象 |
| a | 溴水褪色 |
| b | 产生淡黄色沉淀 |
| c | 滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去 |
根据实验现象进行分析:
① a中实验现象证明Na2SO3具有 性。
② b中发生反应的离子方程式是 。
③ 应用化学平衡原理解释c中现象(用化学用语及简单文字表述) 。
(2)在用NaOH 溶液吸收SO2的过程中,往往得到Na2SO3和NaHSO3的混合溶液,溶液pH 随n(SO32-):n(HSO3-) 变化关系如下表:
| n(SO32—): n(HSO3—) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
① 当吸收液中n(SO32-):n(HSO3-) ="10:1" 时,溶液中离子浓度关系正确的是 (填字母)。
A.c(Na+) +c(H+) = 2c(SO32-) +c(HSO3-) + c(OH-)
B.c(Na+) > c(HSO3-) > c(SO32-) > c(OH-)>c(H+)
C.c(Na+) > c(SO32-) > c(HSO3-) > c(OH-)>c(H+)
②若n(SO32-):n(HSO3-) = 3:2,则0.8 mol NaOH溶液吸收了标准状况下的SO2 L。
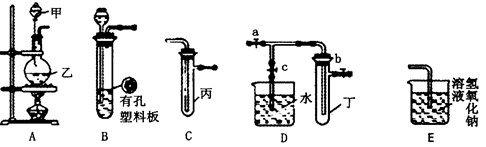

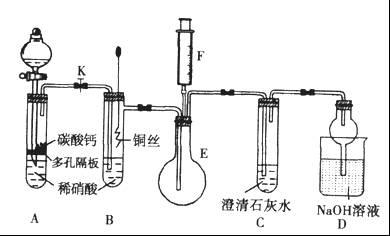
 溶液的作用是________________。
溶液的作用是________________。