题目内容
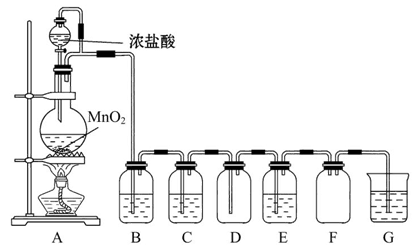
某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。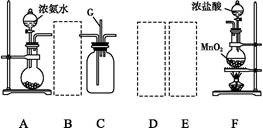
(1)装置F中发生反应的离子方程式为 。
(2)装置A中的烧瓶内固体可选用 (填以下选项的代号)。
A.碱石灰 B.生石灰 C.二氧化硅 D.五氧化二磷 E.烧碱
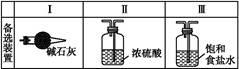
(3)虚线框内应添加必要的除杂装置,请从上图的备选装置中选择,并将编号填入下列空格:B ,D ,E (均填编号)。
(4)氯气和氨气在常温下相混就会反应生成氯化铵和氮气,装置C内出现浓厚的白烟并在容器内壁凝结,请设计实验方案鉴定该固体就是氯化铵: 。
(5)从装置C的出气管口处逸出的尾气可能含有污染环境的气体,如何处理?
。
(1)MnO2+4H++2Cl- M
M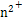 +Cl2↑+2H2O
+Cl2↑+2H2O
(2)A、B、E
(3)Ⅰ Ⅱ Ⅲ
(4)取一定量该固体加水溶解,将该溶液分成两份于试管中,向其中一份中加入NaOH溶液,加热,生成的气体能使湿润的红色石蕊试纸变蓝,说明含N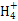 ;向另一份溶液中加入HNO3酸化,然后加入AgNO3,出现白色沉淀,说明含Cl-;通过上述现象即可证明该固体是氯化铵
;向另一份溶液中加入HNO3酸化,然后加入AgNO3,出现白色沉淀,说明含Cl-;通过上述现象即可证明该固体是氯化铵
(5)将尾气通入盛有稀NaOH溶液的烧杯中
解析

 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。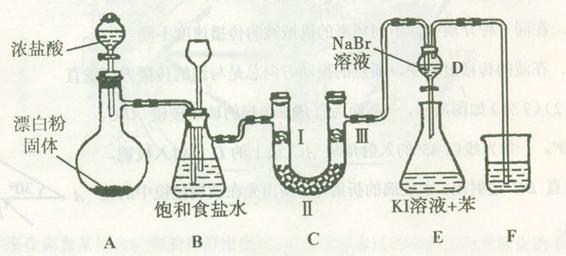
(1)装置A是氯气的发生装置,请写出相应反应的化学方程式: 。
(2)装置B中饱和食盐水的作用是 ;同时装置B也是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象: 。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III处依次放入物质的组合应是 (填字母编号)。
| 编号 | I | II | III |
| a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
| c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
| d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘单质的氧化性。反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是 ,该现象 (填“能”或“不能”)说明溴单质的氧化性强于碘,原因是 。
(5)装置F的作用是 ,其烧杯中的溶液不能选用下列中的 (填字母编号)。
a.饱和NaOH溶液 b.饱和Ca(OH)2溶液
c.饱和Na2SO3溶液 d.饱和Na2CO3溶液



 MnCl2+Cl2↑+2H2O。若有6 mol的HCl参加反应,则转移的电子总数为 。
MnCl2+Cl2↑+2H2O。若有6 mol的HCl参加反应,则转移的电子总数为 。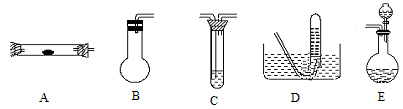
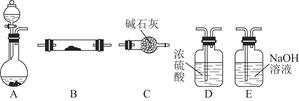
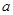 方案制N2时,需要的氨气用生石灰和浓氨水作原料制取,则宜采用上述仪器中的____________(填A、B、C……下同)作NH3的发生器,要制取并收集N2,还须选用到的仪器是___________。
方案制N2时,需要的氨气用生石灰和浓氨水作原料制取,则宜采用上述仪器中的____________(填A、B、C……下同)作NH3的发生器,要制取并收集N2,还须选用到的仪器是___________。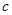 方案制取N2,则氮气中一定混有何种杂质气体 ______________________
方案制取N2,则氮气中一定混有何种杂质气体 ______________________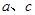 方案结合使用越来越受到人们的关注,这种方法与
方案结合使用越来越受到人们的关注,这种方法与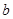 方案相比,其优越性在于____________。
方案相比,其优越性在于____________。