题目内容
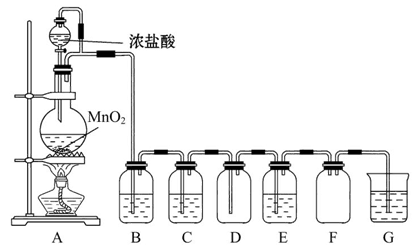
某化学兴趣小组的同学利用所示实验装置进行实验(图中a、b、c表示止水夹)。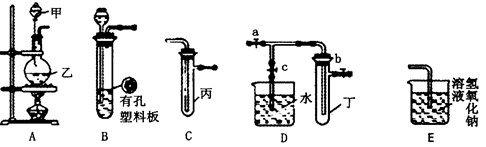
请按要求填空:
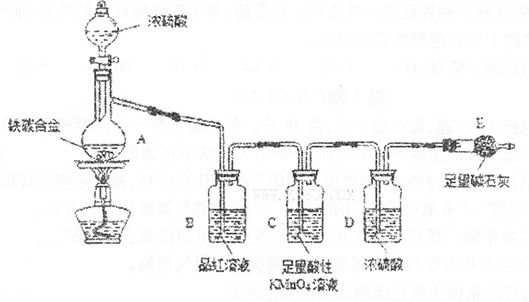
(1)利用B装置可制取的气体有__________(填2种)。
(2)A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验。若在丙中加入适量水,即可制得氯水。将所得氯水分成两份,进行Ⅰ、Ⅱ两个实验,实验操作、现象结论如下:
请你评价实验Ⅱ结论是否合理?_____________;理由:______________。
(3)请利用上述A、C装置设计一个简单的实验,验证Cl2和Br2的氧化性强弱(分别指出甲、乙、丙中盛装的试剂、实验现象及结论)_____________。
(4)B、D、E装置相连后,在B中盛装足量浓硝酸和铜片(放在有孔塑料板上),可制得NO2并进行有关实验。
①B中发生反应的化学方程式为____________________________。
②欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹a、b,再打开止水夹c,使烧杯中的水进入试管丁的操作是_______________________。
③试管丁中的NO2与一定量的O2混合充满后倒插水中,试管9/10充满水,则原试管丁中的混合气体平均相对分子质量可能为_________。(只填一种即可,保留二位小数)
(1)H2、CO2、H2S等;(2)不合理;因为制取的氯气中含有的HCl气体,HCl溶于水后也能与NaHCO3粉末反应产生气泡;(3)在甲、乙、丙中分别装入浓HCl、MnO2、NaBr溶液,烧瓶中有黄绿色气体生成,试管中溶液有无色变为橙色,证明Cl2的氧化性强于Br2;(4)Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;双手握热试管丁,使2NO2与水接触; 42.08或44.04
解析试题分析:(1)利用该装置制取的气体应该是:块状固体和液体反应制取气体;反应不需要加热,制取的气体难溶解于水。可以制取H2、 CO2 、H2S等。(2)(2)不合理;因为制取的氯气中含有的HCl气体,HCl溶于水后也能与NaHCO3粉末反应产生气泡;应该先将HCl除去再进行实验就可以了。(3)氧化性强的能把氧化性弱的物质从它的化合物中置换出来。在甲、乙、丙中分别装入浓HCl、MnO2、NaBr溶液,烧瓶中有黄绿色气体生成,试管中溶液有无色变为橙色,证明Cl2的氧化性强于Br2;(4)①铜和浓硝酸反应的方程式是Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O; ②,使烧杯中的水进入试管丁的操作是双手握热试管丁,使2NO2与水接触;③剩余气体可能是O2也可能是NO。假设试管容积是10V,若剩余气体是O2。则根据4NO2+O2+2H2O=4HNO3,可知剩余氧气为V,反应9V其中NO2是(4/5)×9V,O2=(1/5)×9V,所以混合气体的平均相对分子质量是[(4/5)×9V×46+{10V-(4/5)×9V}×32]÷10V=42.08。若剩余气体是NO根据3NO2+H2O=2HNO3+NO相当于剩余NO23V。反应消耗气体7V。根据4NO2+O2+2H2O=4HNO3可知氧气体积为(1/5)×7V. NO2体积为{10V-(1/5)×7V }.混合气体平均相对分子质量为:[{10V-(1/5)×7V }×46+(1/5)×7V×32] ÷10V=44.04.
考点:考查气体的制备及NO2与O2混合气体与水反应的情况的计算的知识。

 轻松课堂标准练系列答案
轻松课堂标准练系列答案清洗和制绒是硅晶片制作的重要步骤之一,硅片化学清洗的主要目的是除去硅片表面杂质(如某些有机物,无机盐,金属、Si、SiO2粉尘等)。常用的化学清洗剂有高纯水、有机溶剂、双氧水、浓酸、强碱等。其中去除硅的氧化物,通常用一定浓度的HF溶液,室温条件下将硅片浸泡1至数分钟。制绒是在硅片表面形成金字塔形的绒面,增加硅对太阳光的吸收。单晶制绒通常用NaOH、Na2SiO3等混合溶液在75~90℃反应25~35 min,效果良好。回答下列问题
Ⅰ.(1)写出晶片制绒反应的离子方程式 ,对单晶制绒1990年化学家Seidel提出了一种的电化学模型,他指出Si与NaOH溶液的反应,首先是Si与OH一反应,生成SiO44一,然后SiO44一迅速水解生成H4SiO4。基于此原理分析反应中氧化剂为 。
(2)本校化学兴趣小组同学,为验证Seidel的理论是否正确,完成以下实验:
| | 实验事实 |
| 事实一 | 水蒸汽在600℃时可使粉末状硅缓慢氧化并放出氢气。 |
| 事实二 | 盛放于铂或石英器皿中的纯水长时间对粉末状还原硅无腐蚀作用。 |
| 事实三 | 普通玻璃器皿中的水仅因含有从玻璃中溶出的微量的碱便可使粉末状硅在其中缓慢溶解。 |
| 事实四 | 在野外环境里,用较高百分比的硅铁粉与干燥的Ca(OH)2和NaOH,点着后焖烧,可剧烈放出H2。 |
| 事实五 | 1g(0.036mo1)Si和20mL含有lgNaOH(0.025mol)的溶液,小心加热(稍微预热),收集到约1700mL H2,很接近理论值(1600mL)。 |
Ⅱ.在工业中利用镁制取硅:2Mg+SiO2
 2MgO+Si,同时有副反应发生:2Mg+Si
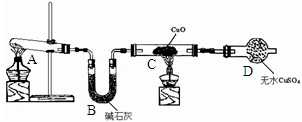
2MgO+Si,同时有副反应发生:2Mg+Si Mg2Si,Mg2Si遇盐酸迅速反应生成SiH4(硅烷),SiH4在常温下是一种不稳定、易分解的气体。如图是进行Mg与SiO2反应的实验装置:
Mg2Si,Mg2Si遇盐酸迅速反应生成SiH4(硅烷),SiH4在常温下是一种不稳定、易分解的气体。如图是进行Mg与SiO2反应的实验装置:
由于氧气的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。 a.石灰石 b.锌粒 c.纯碱
(4)实验开始时,必须先通入X气体,再加热反应物,其理由是______________________________,当反应开始后,移走酒精灯反应能继续进行,其原因是___________________________。
(5)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸。可观察到闪亮的火星,产生此现象的原因用化学方程式表示为_______________________________________。
某兴趣小组研究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示: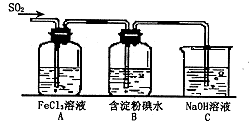
(1)SO2气体与Fe3+反应的主要产物是____、 。(填离子符号)
(2)下列实验方案可以用于在实验室制取所需SO2的是 。
| A.Na2SO3溶液与HNO3 | B.Na2SO3固体与浓硫酸 |
| C.固体硫在纯氧中燃烧 | D.铜与热浓H2SO4 |
(4)如果有280mL SO2气体(已折算为标态)进入C装置中,则C中,50mL NaOH溶液的浓度至少为 mol/L才能达到目的。
(5)在上述装置中通入过量的SO2为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去。
方案②:往第一份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第二份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是 ,原因是 。
(6)能表明I—的还原性弱于SO2的现象是 ,写出有关离子方程式: 。


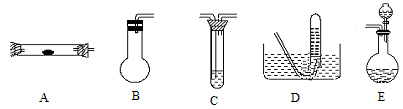
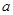 方案制N2时,需要的氨气用生石灰和浓氨水作原料制取,则宜采用上述仪器中的____________(填A、B、C……下同)作NH3的发生器,要制取并收集N2,还须选用到的仪器是___________。
方案制N2时,需要的氨气用生石灰和浓氨水作原料制取,则宜采用上述仪器中的____________(填A、B、C……下同)作NH3的发生器,要制取并收集N2,还须选用到的仪器是___________。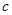 方案制取N2,则氮气中一定混有何种杂质气体 ______________________
方案制取N2,则氮气中一定混有何种杂质气体 ______________________ 方案结合使用越来越受到人们的关注,这种方法与
方案结合使用越来越受到人们的关注,这种方法与 方案相比,其优越性在于____________。
方案相比,其优越性在于____________。